题目内容
实验室制备Cl2,可以用下列三种方法:
①MnO2+4HCl(C)
MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(C)=2KCl+2MnCl2+5Cl2↑+8H2O
③KClO3+6HCl(C)=KCl+3Cl2↑+3H2O
如果分别用上述三种方法制得相同体积的Cl2,下列描述正确的是( )
①MnO2+4HCl(C)
| ||
②2KMnO4+16HCl(C)=2KCl+2MnCl2+5Cl2↑+8H2O
③KClO3+6HCl(C)=KCl+3Cl2↑+3H2O
如果分别用上述三种方法制得相同体积的Cl2,下列描述正确的是( )
| A、同温同压下制得相同体积的Cl2时,三个反应中被氧化的HCl的物质的量相同 |
| B、同温同压下制得相同体积的Cl2时,三个反应中电子转移的总数相等 |
| C、同温同压下制得相同体积的Cl2时,三个反应中消耗的氧化剂的物质的量相同 |
| D、同温同压下制得相同体积的Cl2时,三个反应中被氧化的氯原子数不同 |
分析:A.盐酸中氯元素的化合价在反应前后如下:HCl→MnCl2,化合价-1→-1,化合价没变化,起酸的作用;HCl→Cl2化合价由-1→0,失电子,作还原剂;令生成氯气都是5mol,根据方程式计算判断;
B.反应①②中氯气是氧化产物,反应③中氯气既是氧化产物又是还原产物,与①②中转移电子数不相等;
C.反应①、②、③的氧化剂分别为MnO2、KMn4、KClO3,令生成氯气都是1mol,根据方程式计算判断;
D.反应①②中氯气是氧化产物,反应③中氯气既是氧化产物又是还原产物,与①②中被氧化的氯离子数不相等.
B.反应①②中氯气是氧化产物,反应③中氯气既是氧化产物又是还原产物,与①②中转移电子数不相等;
C.反应①、②、③的氧化剂分别为MnO2、KMn4、KClO3,令生成氯气都是1mol,根据方程式计算判断;
D.反应①②中氯气是氧化产物,反应③中氯气既是氧化产物又是还原产物,与①②中被氧化的氯离子数不相等.
解答:解:同温同压下,体积之比等于物质的量之比,所以在同温同压下,相同体积的任何气体含有相同的分子数,物质的量也相同.
A.MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 4mol 1mol 2mol
令生成氯气都是5mol,由方程式可知反应①、②、③中参加反应的HCl的物质的量分别为:20mol、16mol、10mol,故得等物质的量的Cl2,被氧化的HCl的物质的量分别为:10mol、8mol、5mol,不相等,故A错误;
B.反应①②中氯气是氧化产物,得到等物质的量的Cl2,二者转移电子数目相等,反应③中氯气既是氧化产物又是还原产物,与①②中转移电子数不相等,故B错误;
C.反应①、②、③的氧化剂分别为MnO2、KMnO4、KClO3,令生成氯气都是1mol,由方程式可知反应①、②、③中消耗氧化剂的物质的量分别为:1mol、0.4mol、
mol,故得等量的Cl2,消耗氧化剂的物质的量不相等,故C错误;
D.反应①②中氯气是氧化产物,得到等量的Cl2,二者被氧化的氯离子数相同,反应③中氯气既是氧化产物又是还原产物,与①②中被氧化的氯离子数不相等,故D正确;
故选D.
A.MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O 被氧化的HCl
1mol 4mol 1mol 2mol
令生成氯气都是5mol,由方程式可知反应①、②、③中参加反应的HCl的物质的量分别为:20mol、16mol、10mol,故得等物质的量的Cl2,被氧化的HCl的物质的量分别为:10mol、8mol、5mol,不相等,故A错误;
B.反应①②中氯气是氧化产物,得到等物质的量的Cl2,二者转移电子数目相等,反应③中氯气既是氧化产物又是还原产物,与①②中转移电子数不相等,故B错误;
C.反应①、②、③的氧化剂分别为MnO2、KMnO4、KClO3,令生成氯气都是1mol,由方程式可知反应①、②、③中消耗氧化剂的物质的量分别为:1mol、0.4mol、
| 1 |
| 3 |
D.反应①②中氯气是氧化产物,得到等量的Cl2,二者被氧化的氯离子数相同,反应③中氯气既是氧化产物又是还原产物,与①②中被氧化的氯离子数不相等,故D正确;
故选D.
点评:本题以实验室制备Cl2的不同方法考查氧化还原反应基本概念与计算,注意氯的化合物中氯元素的化合价是解答本题的关键,题目难度中等.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
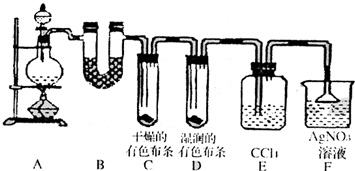 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.