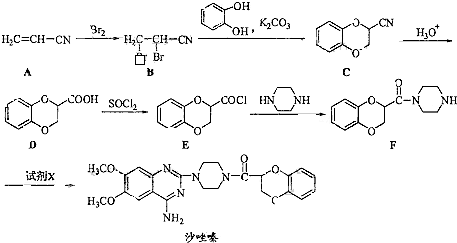
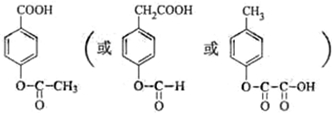
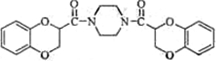
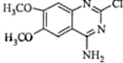
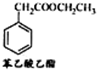
题目内容
(2009?江苏)废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1H2(g)+
O2(g)═H2O(l)H=-285.84KJ?mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol?L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是
(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是
BD
BD
(填字母).A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H=64.39KJ?mol-12H2O2(l)═2H2O(l)+O2(g)H=-196.46KJ?mol-1H2(g)+
| 1 |
| 2 |
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1
.(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol?L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3mol?L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
H2O2分解速率加快
H2O2分解速率加快
.(4)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是
2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+
2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+
.分析:(1)根据资源的回收利用可实现资源再生,并减少污染来分析;
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式.
(2)根据已知的热化学反应方程式和盖斯定律来分析Cu与H2O2反应生成Cu2+和H2O的热化学方程式;
(3)根据双氧水的性质来分析化学反应速率的变化;
(4)根据反应物与生产物来书写离子方程式.
解答:解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ?mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ?mol-1;
③H2(g)+
O2(g)═H2O(l)H3=-285.84KJ?mol-1;
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×
+③得到,
由盖斯定律可知该反应的反应热△H=H1+H2×
+H3=64.39KJ?mol-1+(-196.46KJ?mol-1)×
+(-285.84KJ?mol-1)=-319.68KJ.mol-1,
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,
该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,
则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+.
故答案为:BD;
(2)由①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)H1=64.39KJ?mol-1;
②2H2O2(l)═2H2O(l)+O2(g)H2=-196.46KJ?mol-1;
③H2(g)+
| 1 |
| 2 |
则反应Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)可由反应①+②×
| 1 |
| 2 |
由盖斯定律可知该反应的反应热△H=H1+H2×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:Cu(s)+H2O2 (l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.68KJ.mol-1;
(3)因温度升高反应速率一般加快,但随反应的进行,H2O2分解速率也加快,则反应Cu+H2O2+2H+=Cu2++2H2O中反应物的浓度减小导致反应速率变慢,
故答案为:H2O2分解速率加快;
(4)由CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,
该反应中Cu元素的化合价降低,S元素的化合价升高,由离子方程式中CuCl保留化学式,并遵循电荷守恒,
则离子方程式为2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O═2CuCl↓+SO42-+2H+.
点评:本题考查的知识比较散,一道题考查了多个知识点,覆盖面比较多,注重了对盖斯定律、热化学方程式、离子方程式等高考中常考考点的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?江苏)I2在KI溶液中存在下列平衡:
(2009?江苏)I2在KI溶液中存在下列平衡: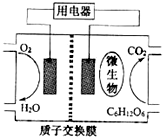 (2009?江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )
(2009?江苏)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述正确的是( )