题目内容
 (2009?江苏)I2在KI溶液中存在下列平衡:
(2009?江苏)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq)
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
分析:A、根据温度升高时平衡移动的方向判断反应的反应热;
B、根据温度变化时平衡移动的方向比较平衡常数的大小;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律比较浓度大小;
B、根据温度变化时平衡移动的方向比较平衡常数的大小;
C、根据D状态与平衡状态比较,判断反应方向进而得出反应速率关系;
D、根据平衡移动规律比较浓度大小;
解答:解:A、随着温度的不断升高,I3-的浓度逐渐的减小,说明反应向逆方向移动,I2(aq)+I-(aq)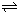 I3-(aq) 是一个放热反应,即△H<0,故A错误;
I3-(aq) 是一个放热反应,即△H<0,故A错误;
B、因为K=
,T2>T1,所以当温度升高时,反应向逆方向移动,即K1>K2;故B正确;
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C正确;
D、温度升高,平衡向逆方向移动,c(I3-)变小,则c(I2)应变大,所以状态B的c(I2)大,故D错误;
故选BC.
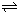 I3-(aq) 是一个放热反应,即△H<0,故A错误;
I3-(aq) 是一个放热反应,即△H<0,故A错误;B、因为K=
| c(I3-) |
| c(I2)×c(I-) |
C、从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,I3-的浓度应增加,平衡向正分析移动,所以v正>v逆,故C正确;
D、温度升高,平衡向逆方向移动,c(I3-)变小,则c(I2)应变大,所以状态B的c(I2)大,故D错误;
故选BC.
点评:本题考查化学平衡的移动和平衡常数的运用,注意化学平衡图象分析的一般方法来解答:一看面:看清图象中横坐标和纵坐标的含义;二看线:弄清图象中线的斜率或线走势的意义;三看点:明确曲线的起点、终点、交点及拐点等;四看是否需要辅助线.

练习册系列答案
相关题目

 (2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(2009?江苏)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.