题目内容
5.写出下列反应的离子方程式:(1)少量二氧化碳通入澄清的石灰水Ca2+20H-+C02=H20+CaC03↓;
(2)硫酸镁溶液与氢氧化钡溶液混合Mg2++Ba2++SO42-+2OH-=Mg(OH)2↓+BaSO4↓;
(3)铁锈(主要成分氧化铁)与稀盐酸反应Fe2O3+6H+═2Fe3++3H2O.;
(4)向NaHSO4溶液中逐滴加入Ba (OH)2溶液至溶液呈中性2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O.
分析 (1)反应生成碳酸钙和水;
(2)硫酸镁溶液与氢氧化钡溶液混合反应生成硫酸钡和氢氧化镁沉淀;
(3)氧化铁与盐酸反应生成氯化铁和水;
(4)向NaHSO4溶液中逐滴加入Ba (OH)2溶液至溶液呈中性反应生成硫酸钡、硫酸钠和水.
解答 解:(1)反应生成碳酸钙和水,离子方程式:Ca2+20H-+C02=H20+CaC03↓;
故答案为:Ca2+20H-+C02=H20+CaC03↓;
(2)硫酸镁溶液与氢氧化钡溶液混合反应生成硫酸钡和氢氧化镁沉淀,离子方程式:Mg2++Ba2++SO42-+2OH-=Mg(OH)2↓+BaSO4↓;
故答案为:Mg2++Ba2++SO42-+2OH-=Mg(OH)2↓+BaSO4↓;
(3)氧化铁与盐酸反应生成氯化铁和水,离子方程式:Fe2O3+6H+═2Fe3++3H2O;
故答案为:Fe2O3+6H+═2Fe3++3H2O;
(4)向NaHSO4溶液中逐滴加入Ba (OH)2溶液至溶液呈中性反应生成硫酸钡、硫酸钠和水,离子方程式:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O;
故答案为:2H++2OH-+Ba2++SO42-═BaSO4↓+2H2O;
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写是解题关键,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
13.实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
20.已知A和B生成C的反应方程式:2 A(g)+B(g)=x C(g).甲容器充入2mol A和1mol B,达平衡后,C在平衡混合气中的体积分数为φ、物质的量n1;乙容器中充入1.4mol A,0.7mol B和0.6mol C,达平衡后C在平衡混合气中的体积数为φ、物质的量为n2,下列说法正确的是( )
| A. | 若甲乙两容器均为恒容容器,则x必等于2 | |
| B. | 若甲乙两容器均为恒压容器,则x必等于3 | |
| C. | 若甲为恒压容器,乙为恒容容器,且x不等于3,则n1必大于n2 | |
| D. | 若甲为恒容容器,乙为恒压容器,且x等于3,则n1必大于n2 |
17.盐X与氢氧化钠共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z溶液反应又生成X,则X可能是下列中的( )
| A. | NH4HCO3 | B. | NH4NO3 | C. | (NH4)2SO4 | D. | NH4Br |
14.气态烃1体积只能与1体积氯气发生加成,生成氯代烷烃,此氯代烷烃1mol可与8mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A. | CH2=CH2 | B. | CH3CH=CH2 | C. | CH3CH3 | D. | CH3CH2CH=CH2 |
15.把一小块金属钠放入水中,下列现象不正确的是( )
| A. | Na浮在水面上 | B. | Na在水面上游动 | ||
| C. | Na沉在水面下 | D. | Na熔成光亮的小球 |
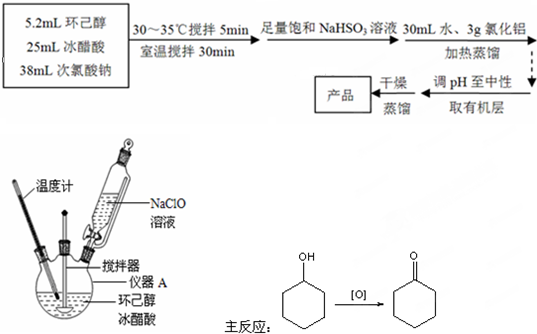
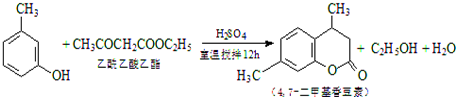
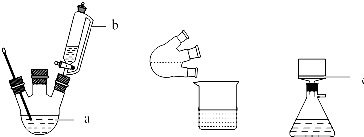
 CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和的碳酸钠溶液(填药品名称)收集粗产品,用分液(填操作名称)的方法把粗产品分离.