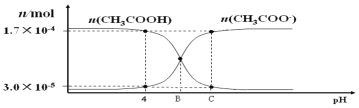
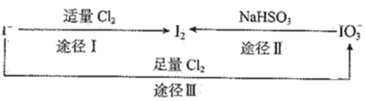
��Ŀ����
����Ŀ��������ҵ��ϴ�ֲ�ʱ�����ķ�Һ��Ҫ�ɷ�ΪFe2+��H+��Cl-�������������������÷�Һ������������Ʊ�������Ϳ�ϡ�
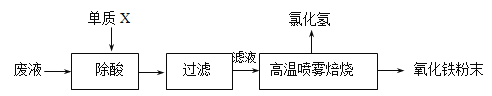
��1������X�Ļ�ѧʽ��___________��
��2���Ȼ�������Һ��������������ת��ΪHCl�������������ĩ���йصĻ�ѧ����ʽ����Ϊ��_____________________________________________________________________��
��3��ij����Ϳ���г�����Fe2O3�⣬������������CuO��FeO�е�һ��,�����ʵ�鷽����̽��������Ϳ����������ijɷ֡�
�� �����������
����1��������CuO
����2��������FeO
�� ����Ʒ�������֤�������裬д��ʵ�鲽�衢Ԥ������ͽ��ۡ�
��ѡ�Լ������ۡ�3molL-1H2SO4��0.1 molL-1����KMnO4��Һ��10%NaOH��Һ��10%H2O2��KSCN��Һ
�������� | Ԥ������ͽ��� |
����1��ȡ������Ʒ���Թ��У�_______________ | ��Ʒȫ���ܽ⣬�õ��������Һ�� |
����2��___________________ | __________________ |
��4������㣬��635gˮ��ȫ��������������������������HCl����___������״���������ɵõ�36.5%��Ũ���ᣨ���ԭ������ Cl 35.5 H 1����
���𰸡�Fe 4FeCl2+ 4H2O+ O2 ��2Fe2O3 + 4HCl ��FeCl2+ 2H2O![]() Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3
Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3![]() Fe2O3+ 3H2O ȡ������Ʒ���Թ��У�����������3molL��1H2SO4������� ȡ����������Һ�ڣ������������ۣ�������ټ�������3molL��1H2SO4������� ���Թ��г��ֺ�ɫ���壬˵����������CuO ȡ��������1��Һ���Թ��У���μ���0.01 molL��1����KMnO4��Һ ����Ϻ�ɫ��ȥ��˵����������FeO 224
Fe2O3+ 3H2O ȡ������Ʒ���Թ��У�����������3molL��1H2SO4������� ȡ����������Һ�ڣ������������ۣ�������ټ�������3molL��1H2SO4������� ���Թ��г��ֺ�ɫ���壬˵����������CuO ȡ��������1��Һ���Թ��У���μ���0.01 molL��1����KMnO4��Һ ����Ϻ�ɫ��ȥ��˵����������FeO 224
��������
��1����Һ��Ҫ�ɷ�ΪFe2+��H+��Cl-��������Һ��Ŀ���ǻ���������Ʊ�������Ϳ�ϣ����뵥��X��Ŀ���dz��ᣬ���Լ����Ӧ������
��2���Ȼ�������Һ��������������ת��ΪHCl�������������ĩ������д�ܵĻ�ѧ����ʽ��Ҳ���Էֲ�д�����η�����������Ӧ��
��3������ͭ���������ܺ����Һ�����û�ͭ���к�ɫ����������֤�������������������ܺ���Һ�е�Fe2+����ʹ���Ը��������Һ��ɫ��֤��
��4�������ʵ����������ļ��㹫ʽ������ҪHCl����������
��1������������̺���Ϣ��Ϸ�ӦFe+2H+=Fe2++H2��֪���Ჽ��ѡ��ĵ���X�ǹ��������ۻ���м��
��2���Ȼ�������ǿ�������Σ���ˮ�⣬����ˮ�ⷴӦ�����ȷ�Ӧ����˸�����ʹ�䳹��ˮ�⣬�����������������Ȼ��⣻�Ȼ��������ݳ����������������ȶ������ױ������е���������Ϊ����������������������ʱ�ֽ⣬������������ˮ����������������Ӧ���Եõ��ܷ�Ӧʽ���ʴ�Ϊ4FeCl2+ 4H2O+ O2 ��2Fe2O3 + 4HCl ��FeCl2+ 2H2O![]() Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3
Fe(OH)2+ 2HCl��4Fe(OH)2+O2+2H2O = 4Fe(OH)3��2Fe(OH)3![]() Fe2O3+ 3H2O��
Fe2O3+ 3H2O��
��3��������1������Fe2O3��CuO����������ˮ�ļ������������ֱ��ѡ���Լ�����CuO�Ĵ��ڣ�������������ϡ�����ܽ�����������������ͭ��Һ���ٸ��ݽ������˳��������Ρ�ͭ�ε����ʣ�Fe+Fe2(SO4)3=3FeSO4��Fe+CuSO4=FeSO4+Cu����˼�����������ۣ���ַ�Ӧ��������ɫ���壬˵����Ʒ�к���CuO����ѡ��NaOH��Һ��۲���Һ����ɫ�����У���Ϊ�����Ӷ�ͭ���ӵļ�����ɸ��ţ�������2������Fe2O3��FeO����������ˮ�ļ������������ֱ��ѡ���Լ�����FeO�Ĵ��ڣ�������������ϡ�����ܽ�����������������������Һ���ٸ����Ρ������ε����ʣ�������Һ����ʹ���Ը��������Һ��ɫ������������Һ����ʹ���Ը��������Һ��ɫ����˼����������Ը��������Һ����ַ�Ӧ����Һ��ɫ��˵����Ʒ�к���FeO������ѡ��KSCN��˫��ˮ���飬��Ϊ�����ӻ�����������ӵļ��飻
��4���������HCl���ΪxL������n=![]() ��m=nM��m����Һ��=m�����ʣ�+m��ˮ����w�����ʣ�=
��m=nM��m����Һ��=m�����ʣ�+m��ˮ����w�����ʣ�=![]() ��100%����
��100%���� ��100%=36.5%�����x= 224L��
��100%=36.5%�����x= 224L��

����Ŀ����ȼú����������β��������������̼������ȴ�������ʵ����ɫ���������ܼ��ŵ�Ŀ�ġ�����β��������̼����Ҫԭ��Ϊ��![]()
![]()
![]() ��һ�������£���һ�ܱ������У��ô�������ø÷�Ӧ�ڲ�ͬʱ���NO��COŨ�����±���
��һ�������£���һ�ܱ������У��ô�������ø÷�Ӧ�ڲ�ͬʱ���NO��COŨ�����±���
ʱ�� | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)д���÷�Ӧ��ƽ�ⳣ������ʽ_______________��
(2)ǰ2s�ڵ�ƽ����Ӧ����![]() __________���ﵽƽ��ʱ��CO��ת����Ϊ__________��
__________���ﵽƽ��ʱ��CO��ת����Ϊ__________��