题目内容
 (2011?南京三模)如图是模拟电化学反应装置图.下列说法正确的是( )
(2011?南京三模)如图是模拟电化学反应装置图.下列说法正确的是( )分析:根据金属的防护,若K置于N处,为电解池,必须让被保护的金属接电源负极;若开关K置于M处,形成原电池,锌作负极,金属铁为正极,金属铁被保护.
解答:解:A、若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,可减缓铁的腐蚀,故A正确;
B、若X为碳棒,开关K置于M处,形成原电池,Fe极为负极,发生氧化反应,铁电极的电极反应式为:Fe-e-═Fe2+,故B错误;
C、若X为锌棒,开关K置于N处,形成电解池,此时金属锌为阳极,金属铁为阴极,两电极电子守恒,电解质溶液是海水,阳极减少的质量与铁电极增加的质量不相等,故C错误;
D、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,发生的电池反应为在碱性溶液中,锌失电子生成氢氧化锌,电极反应为:2Zn+O2+2H2O═2Zn(OH)2,故D正确;
故选AD.
B、若X为碳棒,开关K置于M处,形成原电池,Fe极为负极,发生氧化反应,铁电极的电极反应式为:Fe-e-═Fe2+,故B错误;
C、若X为锌棒,开关K置于N处,形成电解池,此时金属锌为阳极,金属铁为阴极,两电极电子守恒,电解质溶液是海水,阳极减少的质量与铁电极增加的质量不相等,故C错误;
D、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,发生的电池反应为在碱性溶液中,锌失电子生成氢氧化锌,电极反应为:2Zn+O2+2H2O═2Zn(OH)2,故D正确;
故选AD.
点评:本题考查学生原电池和电解池的工作原理以及金属的腐蚀和防护知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
相关题目

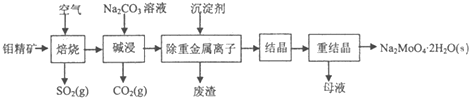
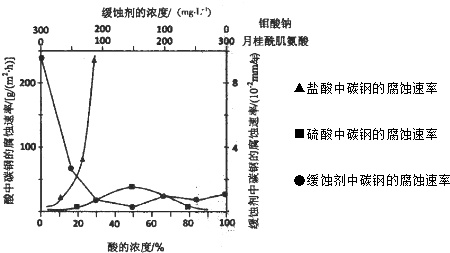
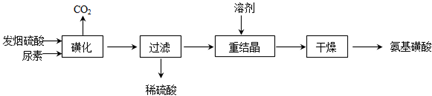
 (2011?南京三模)核能源已日益成为当今世界的主要能源.
(2011?南京三模)核能源已日益成为当今世界的主要能源.