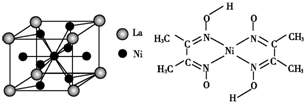
题目内容
13.表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
分析 短周期元素,由元素的化合价可知,T、R都有-2价,处于ⅥA族,T原子半径小于R,则T为O元素,R为S元素,L、Q都有+2,处于ⅡA族,原子半径L>Q,则L为Mg元素,Q为Be元素,M中含有+3价,处于ⅢA族,M原子半径介于L、R之间,则M为Al元素.
A.核外电子数=质子数-离子带的电荷;
B.氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水;
C.非金属性越强,气态氢化物越稳定;
D.金属性越强,与酸反应越剧烈.
解答 解:短周期元素,由元素的化合价可知,T、R都有-2价,处于ⅥA族,T原子半径小于R,则T为O元素,R为S元素,L、Q都有+2,处于ⅡA族,原子半径L>Q,则L为Mg元素,Q为Be元素,M中含有+3价,处于ⅢA族,M原子半径介于L、R之间,则M为Al元素.
A.L2+的核外电子数为12-2=10,R2-的核外电子数为16-(-2)=18,不相等,故A错误;
B.M与T形成的化合物是氧化铝,氧化铝能与酸反应生成相应的盐与水,与碱反应生成相应的盐与水,是两性氧化物,故B正确;
C.T为O元素,R为S元素,非金属性O>S,则气态氢化物的稳定性H2O>H2S,故C错误;
D.金属性Mg比Be强,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>Q,故D错误;
故选:B.
点评 本题考查结构性质位置关系应用,利用原子半径及化合价来推断出元素是解答本题的关键,并熟悉元素及其单质、化合物的性质,难度不大.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
1.在常温常压下,取下列等质量4种气态烃,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
18.甲烷分子中4个氢原子被苯基取代,可得如图所示分子,对该分子的描述正确的是( )


| A. | 此物质是苯的同系物 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有3种 | D. | 此物质分子式为C25H22 |
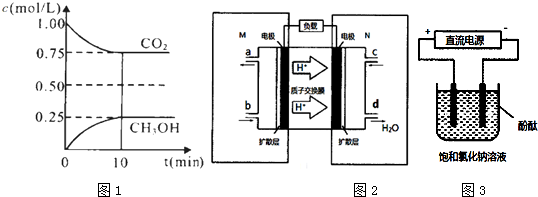

 .
.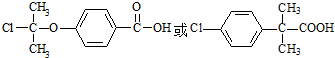 .
. (R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备
(R、R′为烃基).根据已有知识并结合相关信息,写出以乙醇为原料制备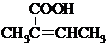 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: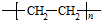



 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$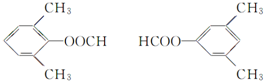 .
.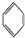 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④