题目内容
对反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4的下列说法正确的是( )
| A、该反应的氧化剂只有CuSO4 | ||
| B、SO42-既不是氧化产物也不是还原产物 | ||
C、1 mol CuSO4还原了
| ||
| D、被还原的S和被氧化的S的质量比为7:3 |
分析:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,Cu元素的化合价由+2价降低为+1价,S元素的化合价由-1价降低为-2价,S元素的化合价由-1价升高为+6价,以此来解答.
解答:解:A.Cu、S元素的化合价降低,则氧化剂为CuSO4、FeS2,故A错误;
B.由S元素的化合价变化及S原子守恒可知,10molS中有3molS失去电子,所以部分SO42-是氧化产物,故B错误;
C.1 mol CuSO4得到电子为1mol×(2-1)=1mol,由电子守恒可知,可氧化
mol的S,故C错误;
D.由S元素的化合价变化及S原子守恒可知,10molS中有3molS失去电子,7molS得到电子,则被还原的S和被氧化的S的质量比为7:3,故D正确;
故选D.
B.由S元素的化合价变化及S原子守恒可知,10molS中有3molS失去电子,所以部分SO42-是氧化产物,故B错误;
C.1 mol CuSO4得到电子为1mol×(2-1)=1mol,由电子守恒可知,可氧化
| 1 |
| 7 |
D.由S元素的化合价变化及S原子守恒可知,10molS中有3molS失去电子,7molS得到电子,则被还原的S和被氧化的S的质量比为7:3,故D正确;
故选D.
点评:本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,注意S元素的化合价变化为解答的易错点,明确Cu、S元素的化合价变化即可解答,题目难度中等.

练习册系列答案
相关题目

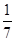 mol的S
mol的S