题目内容
11.硫及其部分化合物的转化关系如图所示.S$→_{①}^{O_{2}}$SO2$→_{②}^{O_{2}}$A$→_{③}^{H_{2}O}$H2SO4$→_{④}^{BaCl_{2}溶液}$BaSO4
(1)①的实验现象为发出淡蓝色火焰,放出大量的热,生成刺激性气味的气体;
(2)SO2能使酸性高锰酸钾溶液褪色,说明SO2具有还原性(填“漂白性”、“还原性”或“氧化性”);
(3)化合物A的名称为三氧化硫;
(4)反应④的离子方程式为Ba2++SO42-=BaSO4↓.
分析 (1)硫燃烧生成刺激性气味二氧化硫,火焰为淡蓝色;
(2)二氧化硫具有还原性,能被酸性高锰酸钾氧化;
(3)A为二氧化硫和氧气反应生成的物质,可判断A为三氧化硫;
(4)反应④是硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸.
解答 解:(1)①为硫的燃烧,硫在空气里燃烧发出淡蓝色火焰,放出大量的热,还能闻到刺激性气味;
故答案为:发出淡蓝色火焰,放出大量的热,生成刺激性气味的气体;
(2)二氧化硫具有还原性,能被酸性高锰酸钾氧化,反应为5SO2+2KMnO4KMnO4+2H2O═K2SO4 +2MnSO4+2H2SO4,即SO2能使酸性高锰酸钾溶液褪色,是因为它具有还原性,
故答案为:还原性;
(3)A为二氧化硫和氧气反应生成的物质,可判断A为三氧化硫,其化学式为SO3;
故答案为:SO3;
(4)反应⑤是硫酸和氯化钡溶液反应生成硫酸钡沉淀和盐酸,反应的离子方程式为:Ba2++SO42-=BaSO4↓,
故答案为:Ba2++SO42-=BaSO4↓.
点评 本题考查了硫及其化合物性质的分析判断,侧重于基础知识的考查,注意二氧化硫漂白性、还原性的辨别,本题难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.坏血病是由哪一种维生素缺乏所引起的( )
| A. | 维生素A | B. | 维生素B1 | C. | 维生素C | D. | 维生B12 |
2.下列关于元素及其化合物的说法正确的是( )
| A. | 光导纤维的主要成分为硅单质 | |
| B. | Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 | |
| C. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 | |
| D. | 制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
19.配制250mL2.00mol/L的NaCl溶液,需要用到下列哪些仪器( )
| A. | 试管 | B. | 烧杯 | C. | 量筒 | D. | 锥形瓶 | ||||
| E. | 容量瓶 | F. | 玻璃棒 |
16.现有a mol丙烯和丙炔的混合气体通入足量的溴的四氯化碳溶液中,充分反应,最多消耗b mol Br2(a<b).则原混合气体中丙烯的体积分数为( )
| A. | $\frac{a-b}{a}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{2a-b}{a}$ | D. | $\frac{2a-b}{b}$ |
3.下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2FeCl2═2FeCl3 | D. | 3O2$\frac{\underline{\;催化剂\;}}{\;}$2O3 |
12.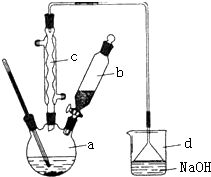 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
(1)写出a中生成溴苯的化学方程式 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;
(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr;
+HBr;(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体,继续滴加至液溴滴完.装置d装置的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0mL水、8mL l0%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为苯;要进一步提纯,下列操作中必须的是D(填入正确选项前的字母).
A.重结晶 B.过滤 C.萃取 D.蒸馏.
 .
.