题目内容
由KCl、MgCl2和MgSO4三种盐配成的混合溶液中,若K+的浓度为0.1mol/L,Mg2+的浓度为0.25mol/L,而Cl-的浓度为0.2mol/L,则SO42-的浓度是( )
| A、0.1 mol/L |
| B、0.4mol/L |
| C、0.3mol/L |
| D、0.2mol/L |
考点:物质的量浓度的相关计算
专题:计算题
分析:混合溶液呈电中性,根据电荷守恒有c(Cl-)+2(SO42-)=c(K+)+2c(Mg2+),据此计算.
解答:
解:混合溶液呈电中性,根据电荷守恒有c(Cl-)+2(SO42-)=c(K+)+2c(Mg2+),故:
0.2mol/L+2(SO42-)=0.1mol/L+0.25mol/L×2
解得:(SO42-)=0.2 mol/L,
故选D.
0.2mol/L+2(SO42-)=0.1mol/L+0.25mol/L×2
解得:(SO42-)=0.2 mol/L,
故选D.
点评:本题考查物质的量浓度的有关计算,难度中等,注意电解质混合溶液中离子浓度的计算经常利用电荷守恒进行计算.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
若1g水中含有m个氢原子,则阿伏加德罗常数可用含m的代数式表示为( )
| A、2m | ||
| B、9m | ||
| C、18m | ||
D、
|
下列离子方程式正确的是( )
| A、碳酸氢钠溶液中滴入少量氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
| C、0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
将如图所示实验装置的K闭合,下列判断正确的是( )
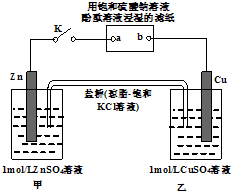

| A、电子沿Zn→a→b→Cu路径流动 |
| B、片刻后甲池中硫酸根离子浓度增大 |
| C、Cu电极上发生还原反应 |
| D、片刻后可观察到滤纸b点变红色 |
能与Cu2+反应,且发生的是氧化还原反应的是( )
| A、OH- |
| B、Ag |
| C、H+ |
| D、Fe |
食用下列食品,通常不会对人体造成危害的是( )
| A、用甲醛溶液浸泡的海鲜品 |
| B、牛奶经工业发酵后得到的酸奶 |
| C、加有苏丹红Ⅰ号调色剂的鲜辣酱 |
| D、二氧化硫熏制后的白面粉? |
下列检验试剂选用正确的是( )
| A、用氯水、KSCN溶液检验FeCl3中是否有FeCl2溶液 |
| B、用酸性KMnO4溶液检验FeCl3中是否有FeCl2 |
| C、用NaOH溶液检验MgCl2中是否有FeCl2 |
| D、用硝酸检验某黄色固体是纯铜还是黄铜 |
下列表示对应化学反应的离子方程式正确的是( )
| A、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
| B、Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- |
| C、醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| D、FeCl3溶液与Cu的反应:Cu+Fe3+═Cu2++Fe2+ |