题目内容
为了缓解能源短缺带来的困扰,新能源越来越受到人们的重视;其中,乙醇就是一种污染较小的有机燃料,新型的乙醇汽车已经研制成功.下表列出了一些物质的燃烧热
(1)氢化热是1mol碳碳双键与氢气发生加成反应生成碳碳单键时的焓变.写出乙烯的氢化热的热化学方程式
(2)瑞尼镍是乙烯氢化反应的重要催化剂之一,它是用NaOH溶液处理铝镍合金,溶去铝后得到灰黑色的小颗粒多孔性的镍粉,写出该过程的化学方程式
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,所需的能量为
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H(kJ?mol-1) | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
C2H4(g)+H2(g)=C2H6(g)△H=-137KJ/mol
C2H4(g)+H2(g)=C2H6(g)△H=-137KJ/mol
.(2)瑞尼镍是乙烯氢化反应的重要催化剂之一,它是用NaOH溶液处理铝镍合金,溶去铝后得到灰黑色的小颗粒多孔性的镍粉,写出该过程的化学方程式
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,所需的能量为
(-1366.8+285.8×3+283×3)×103/3×Vm
(-1366.8+285.8×3+283×3)×103/3×Vm
kJ(请用上述数据列出计算式,不必计算出结果)分析:(1)依据热化学方程式的书写原则、物质的燃烧热、氢化热概念分析写出;
(2)用氢氧化钠溶液除去铝的反应是铝和氢氧化钠反应生成偏铝酸钠和氢气;依据化学方程式原子守恒写出;
(3)依据燃烧热的概念和热化学方程式,结合盖斯定律进行计算判断;
(2)用氢氧化钠溶液除去铝的反应是铝和氢氧化钠反应生成偏铝酸钠和氢气;依据化学方程式原子守恒写出;
(3)依据燃烧热的概念和热化学方程式,结合盖斯定律进行计算判断;
解答:解:(1)氢化热是1mol碳碳双键与氢气发生加成反应生成碳碳单键时的焓变,所以得到加成反应为:C2H4(g)+H2(g)=C2H6(g);反应的焓变的计算可以利用燃烧热结合盖斯定律计算得到:
①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0KJ/mol;②H2(g)+
O2(g)=H2O(l)△H=-285.8KJ/mol;③C2H6(g)+
O2(g)=2CO2(g)+H2O(l)△H=-1559.8KJ/mol
依据盖斯定律,①+②-③得到:C2H4(g)+H2(g)=C2H6(g);△H=-137KJ/mol;
故答案为:C2H4(g)+H2(g)=C2H6(g);△H=-137KJ/mol;
(2)用NaOH溶液处理铝镍合金,溶去铝的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,各物质的燃烧热化学方程式为:
①C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l));△H=-1366.8KJ/mol;
②CO(g)+
O2(g)=CO2(g);△H=-283KJ/mol;
③H2(g)+
O2(g)=H2O(l);△H=-285.6KJ/mol;
①-②×3-③×3得到:C2H6O(l)+CO2(g)=3CO(g)+3H2(g);△H=(-1366.8+3×285.58+3×283)KJ/mol;
所以氢气体积为1m3(标准状况)时,所需的能量为:(-1366.8+3×285.58+3×283)×
;
故答案为:(-1366.8+3×285.58+3×283)×
;
①C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0KJ/mol;②H2(g)+
| 1 |
| 2 |
| 7 |
| 2 |
依据盖斯定律,①+②-③得到:C2H4(g)+H2(g)=C2H6(g);△H=-137KJ/mol;
故答案为:C2H4(g)+H2(g)=C2H6(g);△H=-137KJ/mol;
(2)用NaOH溶液处理铝镍合金,溶去铝的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,各物质的燃烧热化学方程式为:
①C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l));△H=-1366.8KJ/mol;
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
①-②×3-③×3得到:C2H6O(l)+CO2(g)=3CO(g)+3H2(g);△H=(-1366.8+3×285.58+3×283)KJ/mol;
所以氢气体积为1m3(标准状况)时,所需的能量为:(-1366.8+3×285.58+3×283)×
| 103 |
| 3×Vm |
故答案为:(-1366.8+3×285.58+3×283)×
| 103 |
| 3×Vm |
点评:本题考查了燃烧热的概念应用和计算,热化学方程式的书写方法和盖斯定律的应用,关键是燃烧热的理解和有关计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
为了缓解能源短缺带来的困扰,新能源越来越受到人们的重视;其中,乙醇就是一种污染较小的有机燃料,新型的乙醇汽车已经研制成功.下表列出了一些物质的燃烧热
(1)氢化热是1mol碳碳双键与氢气发生加成反应生成碳碳单键时的焓变.写出乙烯的氢化热的热化学方程式______.
(2)瑞尼镍是乙烯氢化反应的重要催化剂之一,它是用NaOH溶液处理铝镍合金,溶去铝后得到灰黑色的小颗粒多孔性的镍粉,写出该过程的化学方程式______.
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,所需的能量为______kJ(请用上述数据列出计算式,不必计算出结果)
| 物质 | 氢气 | 一氧化碳 | 乙烷 | 乙烯 | 乙醇 |
| 化学式 | H2(g) | CO(g) | C2H6(g) | C2H4(g) | C2H5OH(l) |
| △H | -285.8 | -283.0 | -1559.8 | -1411.0 | -1366.8 |
(2)瑞尼镍是乙烯氢化反应的重要催化剂之一,它是用NaOH溶液处理铝镍合金,溶去铝后得到灰黑色的小颗粒多孔性的镍粉,写出该过程的化学方程式______.
(3)乙醇和CO2生成H2和CO混合气体,当其中氢气体积为1m3(标准状况)时,所需的能量为______kJ(请用上述数据列出计算式,不必计算出结果)
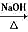 CH3CH2OH +HBr
CH3CH2OH +HBr 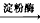 C6H12O6(葡萄糖)
C6H12O6(葡萄糖)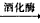 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑