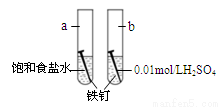
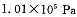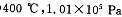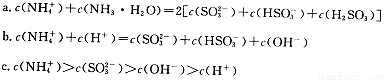题目内容
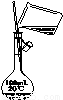
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
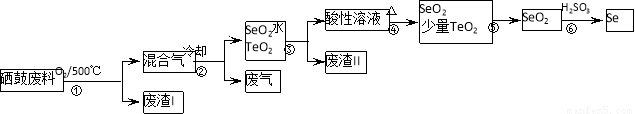
已知:
物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
(14分)
(1)
(2)增大接触面积,加快反应速率,使废料充分燃烧
 (3)CO2 TeO2
(3)CO2 TeO2
(4)H2SeO3 SeO2+H2O 2H2SO3 + SeO2=Se+2H2SO4
(5)升华,将温度控制在315℃到450℃之间
【解析】
试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华,将温度控制在315℃到450℃之间
考点:考查Se元素的性质,电子式、化学方程式的书写,物质分离方法的判断

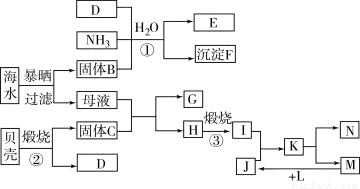
(12分)有A、B、C、D、E五种原子序数小于18的元素,其特征信息如下:
元素编号 | 特征信息 |
A | 其中一种原子核内只有质子没有中子 |
B | 其原子的L层电子数是K层的3倍 |
C | 其阳离子与B的阴离子具有相同的电子层结构, 且核电荷数与B相差3 |
D | 其原子的最外层电子数等于电子层数,且是地壳 中含量较多的元素之一 |
E | 单质为黄绿色气体,可用于制造漂白粉 |
请回答以下问题:
(1)由A、B、C三种元素形成的化合物含有的化学键类型是 。
(2)由A、B、C元素中两两组合形成的化合物相互反应生成单质的化学方程
式 。
(3)D单质与由A、B、C三种元素形成的化合物的水溶液反应的离子方程式
。
(4)写出实验室用软锰矿(MnO2)制取E的化学方程式 。
(5)C和D两元素形成的单质活泼些较强的是 (写元素符号),判断依据是 。