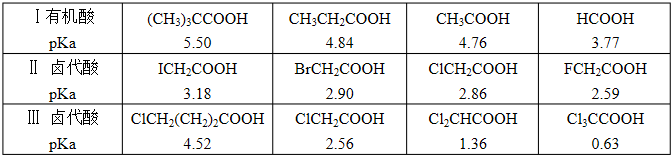
题目内容
16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
| A、Na2CO3,O2,H2O(g) |
| B、Na2CO3,Na2O,O2 |
| C、Na2CO3,CO2,O2,H2O(g) |
| D、NaHCO3,Na2CO3,O2 |
考点:化学方程式的有关计算,钠的重要化合物
专题:
分析:在密闭容器中充分加热,2NaHCO3
Na2CO3+CO2↑+H2O,计所产生的气体CO2和H2O与Na2O2的反应为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,最终可以看作生成的二氧化碳先与过氧化钠反应,然后水再与过氧化钠反应.计算16.8gNaHCO3分解生成的二氧化碳、水的质量,再根据二氧化碳与过氧化钠的反应进行过量计算判断是否有过氧化钠剩余,若过氧化钠剩余,则与水反应生成氢氧化钠,再根据剩余过氧化钠与水的量进行判断,据此解答.
| ||
解答:
解:2NaHCO3
Na2CO3+CO2↑+H2O
168 44 18
16.8 g 4.4g 1.8 g
2CO2+2Na2O2=2Na2CO3+O2,
88 156
4.4g 7.8g
7.8g Na2O2恰好与NaHCO3分解产生的4.4gCO2完全反应生成Na2CO3和O2,所以最后容器内的物质是Na2CO3、O2、H2O(g),
故选A.
| ||
168 44 18
16.8 g 4.4g 1.8 g
2CO2+2Na2O2=2Na2CO3+O2,
88 156
4.4g 7.8g
7.8g Na2O2恰好与NaHCO3分解产生的4.4gCO2完全反应生成Na2CO3和O2,所以最后容器内的物质是Na2CO3、O2、H2O(g),
故选A.
点评:本题考查钠重要化合物性质、混合物的有关计算,难度中等,注意过氧化钠与水、二氧化碳反应的性质,注意转化为二氧化碳、水与过氧化钠反应的先后问题进行的解答.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列关于同系物、同分异构体的叙述中不正确的是( )
| A、互为同系物的两种物质不可能互为同分异构体 |
| B、互为同分异构体的两种物质不可能互为同系物 |
| C、具有相同通式的有机物不一定互为同系物 |
| D、互为同分异构体的两种物质物理性质不同,但化学性质相同 |
剧毒的氰化物可与碱发生反应2CN-+8OH-+5C12═2CO2+N2+10C1-+4H2O下列判断正确的是( )
| A、当有0.2 mol CO2生成时,溶液中阴离子的物质的量增加l mol |
| B、该反应中,每有2mol CN-反应,转移电子为10 mol |
| C、上述反应中的还原剂是OH- |
| D、还原性:Cl->CN- |
3Cl2+8NH3=6NH4Cl+N2的反应中,被氧化的NH3与未被氧化的NH3的分子数之比为( )
| A、1:6 | B、3:1 |
| C、1:3 | D、6:1 |
设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A、阿伏加德罗常数NA是0.012 kg C-12中所含的原子数 |
| B、1 g氢气所含氢原子数目为NA |
| C、22.4 L H2O分子中氢原子与氧原子个数比为2:1 |
| D、1 mol?L-1 NaOH溶液中所含有的Na+离子数目为NA |