题目内容
14.NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 | |
| B. | 二氧化碳通过Na2O2粉末,反应后固体物质减轻 | |
| C. | 1molNa2O2固体中含离子总数为4NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
分析 A.钠为1价金属,1mol钠完全反应失去1mol电子;
B.依据方程式2Na2O2+2CO2═2Na2CO3+O2判断;
C.过氧化钠含有钠离子和过氧根离子;
D.过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子;
解答 解:A.无论生成氧化钠还是过氧化钠,1mol钠完全反应失去1mol电子,钠失去电子数为NA,故A正确;
B.依据方程式2Na2O2+2CO2═2Na2CO3+O2,消耗88g二氧化碳,放出32g氧气,所以固体质量增加,故B错误;
C.1molNa2O2固体中含2mol钠离子和1mol过氧根离子,共含有离子总数为3NA,故C错误;
D.过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子,则当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,题目难度不大.

练习册系列答案
相关题目
4.有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;
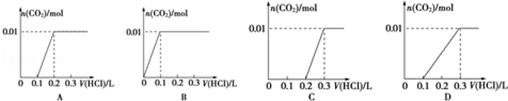
(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3-OH- Cl- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸酸化的硝酸钡溶液,只有A中放出无色气体,只有D中产生白色沉淀;
⑤将B、C两溶液混合,未见沉淀或气体生成;
⑥A与E的溶液中具有相同的阳离子.根据上述实验填空:
(1)写出B、D的化学式:BKCl,DCuSO4;
(2)A受热分解的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)将含0.01mol A的溶液与含0.02mol E的溶液反应后,向溶液中滴加0.1mol•L-1稀盐酸.
下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是C;

(4)向C中滴加过量E溶液,可用一个离子方程式表示Al3++4OH-=AlO2-+H2O;若在1L 0.1mol/L C溶液中加入175mL 2mol/L的E溶液,生成沉淀的物质的量是0.05mol.
2.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 盐酸与NaOH溶液反应 | B. | 碳酸氢铵受热分解 | ||
| C. | 铝粉与MnO2反应 | D. | 氧化钙溶于水 |
9.下列实验操作正确的是( )
| A. | 过滤时用玻璃棒搅拌漏斗里的液体 | |
| B. | 加热后的蒸发皿用坩埚钳夹取 | |
| C. | 用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
6.下列各组物质之间不能发生置换反应的是( )
| A. | 氯水加入溴化钠溶液中 | B. | 用一氧化碳还原三氧化二铁 | ||
| C. | 高温下碳与二氧化硅反应 | D. | 铜丝加入到硝酸银溶液中 |
3.下列各溶液中,有关微粒的物质的量浓度的叙述正确的是( )
| A. | 25℃时,NH4Cl与NH3•H2O混合溶液中:c(C1-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 将pH=3的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 将pH=2 HCl与pH=12 NH3•H2O溶液等体积混合,混合后溶液中c(H+)=c(OH-) | |
| D. | 0.01mol•L-1Na2CO3溶液与0.01mol•L-1NaHCO3溶液等体积混合一定存在:3c(CO32-)+3c(HCO3-)+3c(H2CO3)=2c(Na+) |
4.如图装置可处理乙醛废水,乙醛在阴、阳极分别转化为乙醇和乙酸.下列说法正确的是( )

| A. | b电极为正极 | |
| B. | 电解过程中,阴极区Na2SO4的物质的量增大 | |
| C. | 阳极电极反应式为CH3CHO-2e-+H2O═CH3COOH+2H+ | |
| D. | 电解过程中,阴、阳极还分别产生少量的O2和H2 |