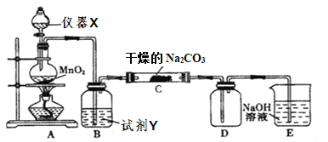
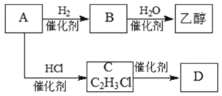
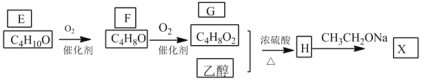
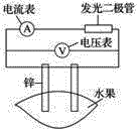
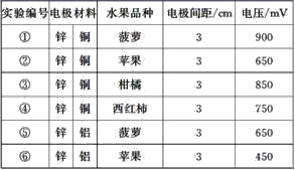
题目内容
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。不能判断该分解反应已经达到化学平衡状态的是( )
A.v正(NH3)=2v逆(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
【答案】D
【解析】
A.根据反应可得出v正(NH3)=2v正(CO2),故当v正(NH3)=2v逆(CO2)时反应达平衡状态,能判断该分解反应已经达到化学平衡,故A不选;
B.随着反应的进行体系压强逐渐增大,容器内压强保持不变说明反应达平衡状态,能判断该分解反应已经达到化学平衡,故B不选;
C.当体系达平衡状态时,混合气体的总质量不变,而容器的体积不变,密闭容器中混合气体的密度不变,说明反应达平衡状态,能判断该分解反应已经达到化学平衡,故C不选;
D.氨气与二氧化碳比例为2∶1,不会随反应方向变化而变化,与平衡无关,不能判断该分解反应已经达到化学平衡,故D选。
故选D。

练习册系列答案
相关题目