题目内容
|
除去CO2气体中含有少量的SO2气体,最好采用的方法是 | |
| [ ] | |
A. |
通过石灰水 |
B. |
通过足量的品红溶液 |
C. |
通过足量的饱和NaHCO3溶液 |
D. |
先通过酸性KMnO4溶液,再通过石灰水 |
提示:
|
首先明确净化气体的原则是:不能引入新的杂质;尽可能不减少被净化气体的量.其次,利用SO2和CO2这两种酸性氧化物性质的区别和联系,选择最佳试剂以达到净化CO2气体的目的. SO2和CO2都是酸性氧化物,它们都能与碱反应,生成盐而进入溶液,故A选项错误;SO2具有漂白性,能与品红溶液反应生成不稳定的化合物,所以足量的品红溶液可以吸收CO2气体中少量的SO2,以除去SO2气体.但是,部分的CO2气体也会溶解于品红溶液中,而使CO2损失,所以B选项不是除去SO2的最佳方法,B选项错误;SO2可以与水反应生成亚硫酸(H2SO3),亚硫酸是一种二元中强酸,酸性大于碳酸(H2CO3),当SO2气体通入饱和NaHCO3溶液时,发生反应:SO2+NaHCO3 SO2是一种具有较强的还原性、漂白性等特性的酸性氧化物;而CO2无还原性、漂白性,解题时运用二者的性质差别,便可得到正确答案.不应片面地注意二者作为酸性氧化物的共性,而忽视了SO2的“个性”. |

下述实验能达到预期目的的是
| 编号 | 实验内容 | 实验目的 |
| A | 金属钠投入硫酸铜溶液中 | 置换出铜 |
| B | 把混有HCl的CO2气体通过饱和碳酸钠溶液中 | 除去CO2气体中HCl杂质 |
| C | 滴加氯化钡溶液产生白色沉淀,再滴加硝酸沉淀不溶解 | 说明某溶液中是否含SO42‾ |
| D | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 |
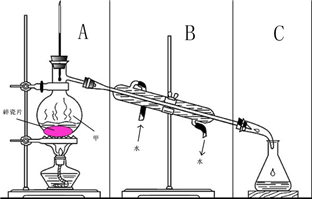 如图所示装置在中学化学实验中常用物质的分离与提纯
如图所示装置在中学化学实验中常用物质的分离与提纯