题目内容
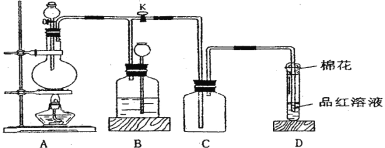
【题目】某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行相关实验。
请回答:
⑴ 装置 A 中发生的化学反应方程式为_________。
⑵ 装置 D 中试管口放置的棉花中应浸一种液体,这种液体最好是下列哪种_________, 其作用是_________。
a.NaOH 溶液 b.NaCl 溶液 c.H2O d.NH4Cl 溶液
⑶ 装置 B 的作用是贮存多余的气体。当 D 处有明显的现象后,关闭旋塞 K 并移去酒精灯,但由于余热的作用,A 处仍有气体产生,此时 B 中现象是_________。B 中应放置的液体是(填字母)_________。
a.水 b.酸性 KMnO4 溶液 c.饱和 NaHSO3 溶液 d.浓溴水
⑷ 实验中,取一定质量的铜片和一定体积 18 mol·L—1 的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是______。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的物质是_________(填字母)。
a.BaCl2 溶液 b.锌粉 c.紫色石蕊试液 d.滴有酚酞的 NaOH 溶液
【答案】2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑ a 吸收多余的二氧化硫,防止污染空气 B中,长颈漏斗中的液面会上升 选c (二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫) 反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 bcd(实质证明氢离子的存在)
CuSO4+2H2O+SO2↑ a 吸收多余的二氧化硫,防止污染空气 B中,长颈漏斗中的液面会上升 选c (二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫) 反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 bcd(实质证明氢离子的存在)
【解析】
(1)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水;
(2)根据二氧化硫是污染性气体,不能排放到大气中分析;
(3)根据储气装置的原理是利用压强大小,密闭容器通过改变液面的高低调节分析,试剂不能和气体反应也不能溶于液体;
(4) ①从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析;
②证明有酸剩余是验证稀硫酸的存在关键是氢离子的检验。
(1)浓硫酸具有强氧化性,在加热时可以氧化单质铜,生成硫酸铜、二氧化硫和水方程式为:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑,
CuSO4+2H2O+SO2↑,
因此,本题正确答案是:2H2SO4(浓)+Cu![]() CuSO4+2H2O+SO2↑;
CuSO4+2H2O+SO2↑;
(2)二氧化硫气体排放到大气中污染环境,所以装置D中试管口放置的棉花中应浸一种液体能与二氧化硫反应,可以浸氢氧化钠溶液或碳酸钠溶液等碱性溶液,故选a.NaOH 溶液,其作用是吸收多余的二氧化硫气体,防止污染空气,
因此,本题正确答案是:a ;吸收多余的二氧化硫,防止污染空气;
(3)装置B的作用是贮存多余的气体,关闭旋塞K,移去酒精灯,但因为余热的作用,A处仍有气体产生,在密闭容器中随着气体的生成,广口瓶内压强增大,会使瓶内液面下降,长颈漏斗中液面上升,最终达到内外大气压相同,二氧化硫气体是酸性氧化物,易溶于水,B中的试剂不能和二氧化硫发生反应,不能溶解二氧化硫,
a.水能溶解二氧化硫不能储存气体,故a错误;
b.酸性KMnO4溶液能氧化二氧化硫为硫酸,不能储存气体,故b错误;
c. 二氧化硫通入饱和NaHSO3溶液中,降低了二氧化硫的溶解度,不反应,可以用来储存气体,故c正确;
d. 浓溴水能氧化二氧化硫不能储存气体,故d错误。
因此,本题正确答案是:瓶中液面下降,长颈漏斗中液面上升;c;
(4) ①一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解,
因此,本题正确答案是:反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应;
②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
a. BaCl2 溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明;
b.锌粉与稀硫酸反应放气体,可以证明;
c.紫色石蕊试液与酸变红,可以证明;
d.滴有酚酞的 NaOH 溶液会与稀硫酸反应,溶液由红色变为无色,可以证明。
因此,本题正确答案是:bcd。

 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案