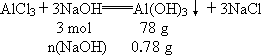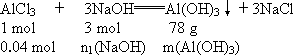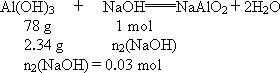题目内容
向20 mL 2 mol·L-1的AlCl3溶液中加入30 mL NaOH溶液,充分反应后得0.78 g沉淀,求NaOH溶液的物质的量浓度.
答案:
解析:
解析:
|
答案:NaOH溶液的物质的量浓度是1 mol·L-1或5 mol·L-1. 解析:(1)假设AlCl3溶液过量,生成的沉淀以氢氧化钠的量为计算依据. n(NaOH)=0.03 mol,c(NaOH)= (2)假设AlCl3溶液不足,生成的沉淀以氯化铝的量为计算依据. m(Al(OH)3)=3.12 g n1(NaOH)=0.12 mol 生成的沉淀会有3.12 g-0.78 g=2.34 g溶解. n总(NaOH)=0.03 mol+0.12 mol=0.15 mol c(NaOH)= |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
| |||||||||||||||||||||