��Ŀ����
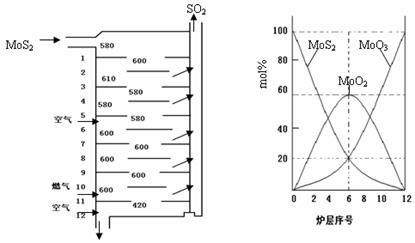
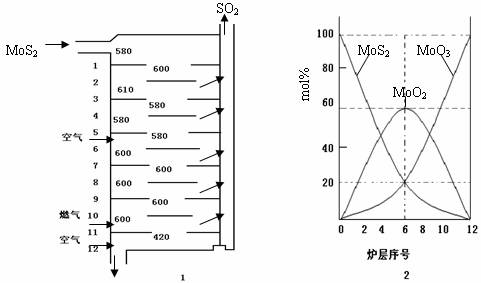
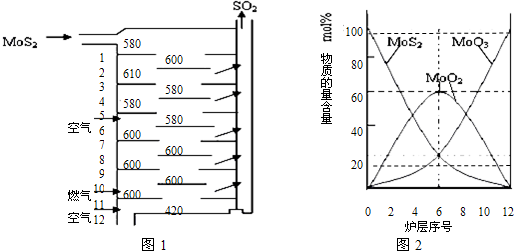
�����MoS2����һ����Ҫ�Ŀ��ͼ1�ǻ�����㱺��¯��ʾ��ͼ������1��2��3������¯���ţ�580��600��610�����Ǹ�¯����¶ȣ��棩��ͼ4�����˸�¯��������ϵ����ʵ����ٷֺ�������֪��MoS2��������1mol MoO3�ķ�Ӧ�ȡ�H1=-1011KJ/mol��MoO2��������1mol MoO3�ķ�Ӧ�ȡ�H2=-154KJ/mol���Իش�
��1����֤����������ɵ�������SO2������SO3�ķ�����
��2������������ɵ�������ʹ�����ữ��KMnO4��Һ��ɫ���û�ѧ����ʽ��ʾ��ɫ��ԭ��
��3����6¯����ڵĹ������ʷֱ���MoS2��MoO3��MoO2�������ǵ����ʵ���֮��Ϊ
��4��ͼ2�������м�¯�㣨4��6�����ܴ���һ�֡�����+���������+�����ķ�Ӧ����д���÷�Ӧ���Ȼ�ѧ��Ӧ����ʽ
��������1������������ʹƷ����ɫ�������ָֻ�ԭɫ���������������и����ʣ�
��2��MoS2��������Ӧ���ɶ��������MoO3�����������ܱ��������������
��3������ͼ��������ڵĹ������ʣ���ϰٷֱȼ������ʵ���֮�ȣ�
��4��������֪�ķ�Ӧ��Ϣ�����ݸ�˹���ɼ��㻯ѧ��Ӧ���ʱ䣮
��2��MoS2��������Ӧ���ɶ��������MoO3�����������ܱ��������������
��3������ͼ��������ڵĹ������ʣ���ϰٷֱȼ������ʵ���֮�ȣ�
��4��������֪�ķ�Ӧ��Ϣ�����ݸ�˹���ɼ��㻯ѧ��Ӧ���ʱ䣮
����⣺��1������������ʹƷ����ɫ�������ָֻ�ԭɫ���������������и����ʣ����ݶ������ʵ����𣺿����ռ��������壬������ͨ��Ʒ����Һ�У��۲쵽Ʒ����Һ��ɫ�������ָֻ�ԭɫ��
�ʴ�Ϊ���ռ��������壬������ͨ��Ʒ����Һ�У��۲쵽Ʒ����Һ��ɫ�������ָֻ�ԭɫ��
��2������������ɵ��������������л�ԭ�ԣ���ʹ�����ữ��KMnO4��Һ��ɫ��ʵ���ǣ�5SO2+2H2O+2KMnO4=K2SO4+2MnSO4+2H2SO4���ʴ�Ϊ��5SO2+2H2O+2KMnO4=K2SO4+2MnSO4+2H2SO4��
��3������ͼ���֪��6����ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2��ͼ�����MoS2��MoO3�����ʵ����ٷֱ�Ϊ20%��MoO2 �����ʵ����ٷֱ�Ϊ60%����MoS2��MoO3��MoO2 �����ʵ���֮��=1��1��3��
�ʴ�Ϊ��1��1��3��
��4����֪��MoS2��������1mol MoO3�ķ�Ӧ�ȡ�H1=-1011KJ/mol��MoO2��������1mol MoO3�ķ�Ӧ�ȡ�H2=-154KJ/mol��
����MoS2��s��+
O2��g��=MoO3��s��+2SO2��g����H=-1011KJ/mol��
��MoO2��s��+
O2��g��=MoO3��s����H=-154KJ/mol
���ݸ�˹���ɼ���õ�MoO2��s��+6MoO3��s��=7MoO2��s��+2SO2��g����H=��H1-7��H2=+67KJ/mol��
�ʴ�Ϊ��MoS2��s��+6MoO3��s��=7MoO2��s��+2SO2��g����H=+67kJ/mol��
�ʴ�Ϊ���ռ��������壬������ͨ��Ʒ����Һ�У��۲쵽Ʒ����Һ��ɫ�������ָֻ�ԭɫ��
��2������������ɵ��������������л�ԭ�ԣ���ʹ�����ữ��KMnO4��Һ��ɫ��ʵ���ǣ�5SO2+2H2O+2KMnO4=K2SO4+2MnSO4+2H2SO4���ʴ�Ϊ��5SO2+2H2O+2KMnO4=K2SO4+2MnSO4+2H2SO4��
��3������ͼ���֪��6����ڵĹ������ʷֱ�ΪMoS2��MoO3��MoO2��ͼ�����MoS2��MoO3�����ʵ����ٷֱ�Ϊ20%��MoO2 �����ʵ����ٷֱ�Ϊ60%����MoS2��MoO3��MoO2 �����ʵ���֮��=1��1��3��
�ʴ�Ϊ��1��1��3��
��4����֪��MoS2��������1mol MoO3�ķ�Ӧ�ȡ�H1=-1011KJ/mol��MoO2��������1mol MoO3�ķ�Ӧ�ȡ�H2=-154KJ/mol��
����MoS2��s��+
| 7 |
| 2 |
��MoO2��s��+
| 1 |
| 2 |
���ݸ�˹���ɼ���õ�MoO2��s��+6MoO3��s��=7MoO2��s��+2SO2��g����H=��H1-7��H2=+67KJ/mol��
�ʴ�Ϊ��MoS2��s��+6MoO3��s��=7MoO2��s��+2SO2��g����H=+67kJ/mol��
���������⿼����ͼ������������жϣ��Ȼ�ѧ����ʽ����д��������˹���ɵļ���Ӧ�ã�ע��֪ʶ��Ǩ�ƺ�Ӧ�ã���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ