题目内容
(16分)某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。A中发生反应的化学方程式: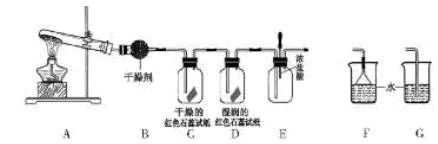
[实验探究]
(1)A中的反应 (填“是”或“不是”)氧化还原反应。
(2)A装置还可用于制取气体 (只填一种)
(3)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是 L
(NH4C1的摩尔质量为53.5g·mol-1)。
(4)实验室收集氨气的方法是
(5)C、D装置中颜色会发生变化的是 (填“C”或“D”)
(6)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,
可观察到的现象是
(7)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处
理装置,合适的装置是 (填“F”或“G”)。
[知识拓展]
(8)生石灰与水反应生成Ca(OH)2并放出热量[化学方程式为CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
[知识应用]
(9)2010 年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500 多居民 深夜大转移。假如你在现场,你会采用什么自救方法?
(1) 不是 (2)O2或氧气其他合理答案也给分 (3)4.48 (4) 向下排空气法 (5)D (6)有白烟生成 (7)F (8)A B (9) ①用湿毛巾捂住口鼻并迅速撤离。②低头弯腰往低处跑迅速撤离。③逆风奔跑迅速撤离。④戴上防毒面具迅速撤离。以上任选其一或其他合理答案也给分
解析试题分析:(1)实验室制取氨气的试剂是熟石灰和氯化铵通过加热制备的,该反应不是氧化还原反应。
(2)根据装置的特点可知,该装置适用于固体和固体之间通过加热制取气体的,因此还可以制取氧气。
(3)10.7gNH4Cl的物质的量是10.7g÷58.5g/mol=0.2mol,所以根据原子守恒可知,生成氨气的物质的量是0.2mol,标准状况下的体积是22.4L/mol×0.2mol=4.48L。
(4)氨气极易溶于水,应该用向下排空气法收集。
(5)氨气只有溶于水才能生成一水合氨,溶液才能显碱性,答案选D。
(6)浓盐酸极易挥发出氯化氢气体,氯化氢极易和氨气结合生成氯化铵而冒白烟。
(7)氨气极易溶于水,如果直接插入水中,会造成溶液倒吸,所以答案选F。
(8)由于氢氧化钠溶于水放出大量的热量,所以选项A和B正确,碳酸钙、浓硫酸和氨水不反应,CD不正确,答案选AB。
(9)氨气具有刺激性气味,且密度小于空气的,所以正确的措施是①用湿毛巾捂住口鼻并迅速撤离。②低头弯腰往低处跑迅速撤离。③逆风奔跑迅速撤离。④戴上防毒面具迅速撤离。
考点:考查氨气的性质、制备、计算及实验安全等问题
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答。
探究性实验的一般思路
1、准确地把握实验目的
2、利用已学知识,分析如何实现这个目的--实验原理
3、结合实验材料,初步确定设计对策--实验方案

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
 a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。
a.取少量固体药品于试管中,然后向试管中滴加稀盐酸,固体全部溶解,将产生的气体通入下列装置。观察到的现象是:溴水无明显变化,澄清石灰水变浑浊。再向滴加稀盐酸反应后的试管中,加Ba(OH)2溶液,无明显现象。