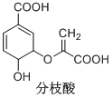
题目内容
【题目】以芳香烃A为原料发生如图所示的变化,可以合成高聚物G。
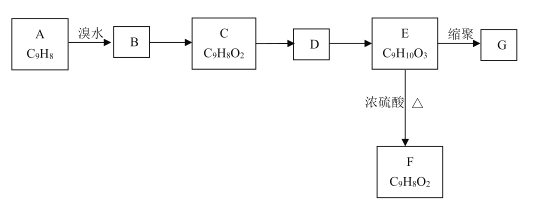
已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是________;C的结构简式为_________。
(2)B→C的反应条件是________,E→F的反应类型是_________。
(3)写出E→G的化学方程式________。
(4)E的同分异构体中,苯环上有4个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。其中核磁共振氢谱显示有4组峰的结构简式为________(写出一种即可)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(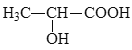 )的合成路线________(无机试剂任选)。
)的合成路线________(无机试剂任选)。
【答案】碳碳三键  NaOH的水溶液,加热 消去 n
NaOH的水溶液,加热 消去 n
![]()
 +(n-1)H2O 16
+(n-1)H2O 16  或
或 CH3C≡CH
CH3C≡CH ![]() CH3CBr2CHBr2
CH3CBr2CHBr2![]() CH3COCHO
CH3COCHO![]() CH3COCOOH
CH3COCOOH![]()
![]()
【解析】
A不饱和度=![]() =6,苯环的不饱和度是4,因为支链上只有3个碳原子,则说明该分子中还含有1个碳碳三键,A和溴水发生加成反应生成B,B发生水解反应生成C,两个羟基连在同一碳原子上不稳定,会自动脱水,C能发生银镜反应,说明C分子中含有-CHO,结合C的分子式知,C结构简式为
=6,苯环的不饱和度是4,因为支链上只有3个碳原子,则说明该分子中还含有1个碳碳三键,A和溴水发生加成反应生成B,B发生水解反应生成C,两个羟基连在同一碳原子上不稳定,会自动脱水,C能发生银镜反应,说明C分子中含有-CHO,结合C的分子式知,C结构简式为 ,B为
,B为![]() ,A为
,A为![]() ;根据E分子式知,C发生氧化反应生成D,D为
;根据E分子式知,C发生氧化反应生成D,D为![]() ,D发生还原反应生成E,E为
,D发生还原反应生成E,E为 ,E发生消去反应生成F为
,E发生消去反应生成F为![]() ;E发生缩聚反应生成G,G为
;E发生缩聚反应生成G,G为 。
。
(5)丙炔CH3C≡CH与溴水发生加成反应CH3CBr2CHBr2,CH3CBr2CHBr2发生水解反应产生CH3COCHO,CH3COCHO被氧化产生CH3COCOOH,CH3COCOOH与H2发生加成反应产生![]() 。
。
根据上述分析可知:A为![]() ,B为
,B为![]() ,C为
,C为 ,D为
,D为![]() ,E为
,E为 ,F为
,F为![]() ,G为
,G为 。
。
(1) A结构简式为![]() ,则A中官能团的名称是碳碳三键;C的结构简式为
,则A中官能团的名称是碳碳三键;C的结构简式为 ;
;
(2) B为![]() ,分子中含Br原子,与NaOH的水溶液在加热条件下发生取代反应产生C:
,分子中含Br原子,与NaOH的水溶液在加热条件下发生取代反应产生C: ,B→C的反应条件是NaOH的水溶液、加热;E为
,B→C的反应条件是NaOH的水溶液、加热;E为 ,分子中含有-OH,由于羟基连接的C原子邻位C原子上有H原子,在浓硫酸存在的条件下发生消去反应产生F:
,分子中含有-OH,由于羟基连接的C原子邻位C原子上有H原子,在浓硫酸存在的条件下发生消去反应产生F:![]() ,即E→F的反应类型是消去反应;
,即E→F的反应类型是消去反应;
(3)E为 ,分子中含有羧基、羟基,与浓硫酸混合加热,发生缩聚反应产生
,分子中含有羧基、羟基,与浓硫酸混合加热,发生缩聚反应产生 和H2O,所以E→G的化学方程式为:n
和H2O,所以E→G的化学方程式为:n
![]()
 +(n-1)H2O;
+(n-1)H2O;
(4)E为 ,E的同分异构体中,苯环上有4个取代基;遇FeCl3溶液显紫色,说明含有酚-OH,与碳酸氢钠溶液反应生成CO2,说明含有-COOH,另外两个取代基是-CH3,符合条件的同分异构体共有16种,其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为
,E的同分异构体中,苯环上有4个取代基;遇FeCl3溶液显紫色,说明含有酚-OH,与碳酸氢钠溶液反应生成CO2,说明含有-COOH,另外两个取代基是-CH3,符合条件的同分异构体共有16种,其中核磁共振氢谱显示有4 种不同化学环境的氢的结构简式为 、
、 ;
;
(5)丙炔CH3C≡CH与溴水发生加成反应CH3CBr2CHBr2,CH3CBr2CHBr2与NaOH的水溶液共热,发生水解反应产生CH3COCHO,CH3COCHO被催化氧化产生CH3COCOOH,CH3COCOOH与H2发生加成反应产生![]() ,所以合成路线为:CH3C≡CH
,所以合成路线为:CH3C≡CH ![]() CH3CBr2CHBr2
CH3CBr2CHBr2![]() CH3COCHO
CH3COCHO![]() CH3COCOOH
CH3COCOOH![]()
![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程。
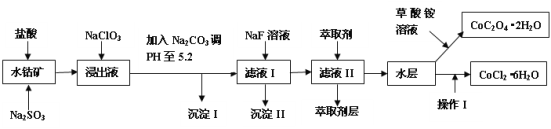
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀I中只含有两种沉淀。
③部分阳离子的氢氧化物形式沉淀时溶液的pH见下表。
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)浸出过程中Co2O3发生反应的离子方程式为___。
(2)在浸出液中加入NaClO3的作用是___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀II的主要成分___。
(4)操作I中包括蒸发浓缩的过程,在蒸发浓缩之前应先向溶液中加入_______(填试剂名称)。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥、称重。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49 g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则在150℃~210℃温度范围放出的气体物质是_______,290℃~320℃温度范围,剩余的固体物质化学式为________。
[已知:CoC2O4·2H2O的摩尔质量为183 g/mol]
【题目】近年来,汽车尾气催化净化成为极其重要的环保产业。请回答下列问题:
I.治理汽车尾气中NO和CO的一种方法是在汽车的排气管道上安装一个催化转化装置。发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
(1)实际测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图一,0~10 s阶段,CO、NO百分含量没有明显变化的原因是______;

(2)在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图二。

①已知T2>T1,则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
②为同时提高反应速率和NO的平衡转化率,可采取的措施有______(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积
c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,该温度下用分压表示的平衡常数Kp=___MPa-1(分压=总压×物质的量分数)。
II.汽车尾气中CO与N2O会发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/ kJ/mol | 475.5 | 283 | 0 | 393.5 |
(3)ΔH=___kJ/mol。
(4)实验室用Fe+作催化剂,以N2O和CO投入比为1:1模拟上述反应,其总反应分两步进行:
第一步:Fe++N2O![]() FeO++N2;
FeO++N2;
第二步:___(写反应方程式)。
催化过程中,c(N2)和c(CO2)几乎相等,由此判断该反应进行的快慢由第___步反应决定。
请在如图中绘制反应在催化剂作用下的“能量~反应过程”示意图___。已知:两步反应均放热。