题目内容
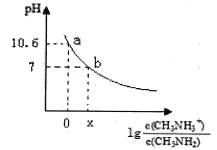
【题目】将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
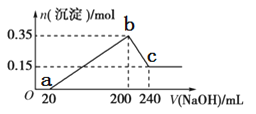
(1)写出bc段发生的化学反应方程式___;
(2)镁和铝的总质量为___g;
(3)b点溶液中的溶质为___,硫酸的物质的量浓度为___mol/L;
(4)生成的氢气在标准状况下的体积为___L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___。
【答案】Al(OH)3+NaOH=NaAlO2+2H2O 9 Na2SO4 2.5 10.08 NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
【解析】
由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O;当V(NaOH溶液)=200mL时,沉淀量最大,此过程中镁离子、铝离子与氢氧根离子反应生成Mg(OH)2和Al(OH)3;从200mL到240mL,NaOH溶解Al(OH)3,据此写出反应的离子方程式;根据沉淀的最大量b点可知氢氧化镁和氢氧化铝的总物质的量,c点为氢氧化镁,根据b、c点可知氢氧化铝的物质的量,然后利用质量守恒计算出镁、铝的物质的量,再根据m=nM计算出混合金属的质量。
(1)bc段氢氧化铝溶解,发生的化学反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O;
(2)根据图像可知Mg(OH)2和Al(OH)3的物质的量之和为0.35mol,从200mL到240mL,NaOH溶解Al(OH)3,当V(NaOH溶液)=240mL时,沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以Mg(OH)2为0.15mol,Al(OH)3为0.35mol-0.15mol=0.2mol,元素守恒可知n(Al)=n[Al(OH)3]=0.2mol,n(Mg)=n[Mg(OH)2]=0.15mol,所以镁和铝的总质量0.2mol×27g/mol+0.15mol×24g/mol=9g,
故答案为:9;
(3)b点溶液中的溶质只有Na2SO4,沉淀量最大时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有n(NaOH)的0.5倍,所以n(Na2SO4)=0.5×0.2L×5mol/L=0.5mol,硫酸的浓度![]() ;
;
(4)根据以上分析,由元素守恒可知金属镁和铝物质的量分别为0.15mol和0.2mol,根据得失电子守恒氢气在标准状况下的体积为:![]() ;
;
(5)c点溶液中的溶质是NaAlO2、Na2SO4,通入足量的CO2,发生反应的化学方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3。