题目内容
12.(CH3CH2)2CHCH3的正确命名是3-甲基戊烷一氯取代物的同分异构体共有4种.该烃是某炔烃经催化加氢后得到,那么炔烃的结构简式是CH≡CCH(CH3)CH2CH3 正确命名是3-甲基-1-戊炔.分析 (CH3CH2)2CHCH3为烷烃,其最长碳链为5,在3号碳上含有1个甲基,据此命名即可;
有几种化学环境的H,此有机物就有几种一氯取代物;
采用还原三键的方法找出此炔烃即可.
解答 解:(CH3CH2)2CHCH3为烷烃,其最长碳链为5,在3号碳上含有1个甲基,正确命名为:3-甲基戊烷,其中含有4种环境不同的H,故其一氯取代物有4种,3-甲基戊烷的碳链中添加碳碳三键后达到的结构为:CH≡CCH(CH3)CH2CH3,正确命名为:3-甲基-1-戊炔,
故答案为:3-甲基戊烷;4种;CH≡CCH(CH3)CH2CH3;3-甲基-1-戊炔.
点评 本题考查了加成反应原理、同分异构体的书写,题目难度不大,注意掌握同分异构体的概念及求算方法,明确加成反应原理为解答本题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量.
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量.
| A. | ①②③ | B. | ②③⑤ | C. | ①③⑤ | D. | ①④⑤ |
20.X、Y、Z、W、T是原子序数依次增大的前四个周期的元素,其中有两种是常见金属元素.其相关信息如表:
(1)X、Y、Z三种元素的电负性由大到小的顺序是O>C>Al(用元素符号表示,下同);在H-X、H-Y两种共价键中,键的极性较大的是H-O.
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
| 元素 | 相关信息 |
| X | X一种核素在考古时常用来坚定一些文物的年代 |
| Y | Y基态原子的s轨道电子与P轨道电子数相等 |
| Z | Z是所在周期的单核离子中半径最小 |
| W | W的单质被誉为“信息革命的催化剂”常用做半导体材料 |
| T | T有多种氧化物,其中一种纯净的氧化物可用来作录音磁带和 电讯器材的原材料 |
(2)T2+的电子排布式为1s22s22p63s23p63d6;T的单质在高温下与Y的氢化物反应,其化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;工业上用W的氧化物与X的单质高温下反应制得W单质的粗产品,其化学反应方程式为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)两种氢化物X2H2和H2Y2中沸点较高的是H2O2,两者沸点相差很大的原因是H2O2分子之间存在氢键,而C2H2分子之间为范德华力.
(4)在25℃、101kPa下,已知W稳定的气态氢化物在Y的气态单质中完全燃烧,恢复至原来状态,平均每消耗4gW稳定的气态氢化物放热190.0KJ,则该反应的热化学方程式SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520kJ/mol.
7.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
| A. | N4的摩尔质量是56 g | |
| B. | N4与N2互为同位素 | |
| C. | 相同质量的N4和N2含原子个数比为1:2 | |
| D. | N4与N2互为同素异形体 |
17.按系统命名法命名时,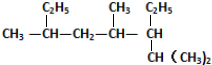 的主链碳原子数是( )
的主链碳原子数是( )
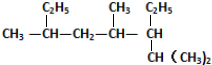 的主链碳原子数是( )
的主链碳原子数是( )| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
1.下列反应或过程需要吸收能量的是( )
| A. | H+H→H-H | B. | H-Cl→H+Cl | ||
| C. | Mg+2HCl=MgCl2+H2↑ | D. | H2SO4+2NaOH=Na2SO4+2H2O |
19.已知25℃时Agl饱和溶液中c(Ag+)为1.22×10-6mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10-6mol/L.若在5mL含有KCl和KI各为0.01mol/L的溶液中,加入8mL0.01mol/LAgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
| A. | c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) | B. | c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) | ||
| C. | c(NO3-)>c(K+)>c(Ag+)>c(Cl-)>c(I-) | D. | c(K+)>c(NO3-)>c(Ag+)=(Cl-)+c(I-) |
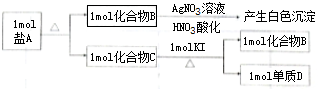
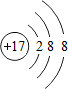 ;
;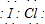 ;化合物C中显正价的是碘元素;
;化合物C中显正价的是碘元素;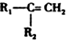 $\stackrel{HBr/过氧化物}{→}$
$\stackrel{HBr/过氧化物}{→}$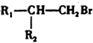 ②
②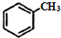 $\stackrel{KMnO/H-}{→}$
$\stackrel{KMnO/H-}{→}$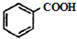
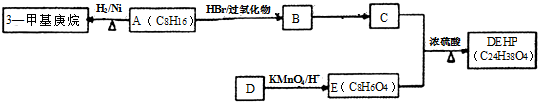
 ;反应类型:取代反应;
;反应类型:取代反应;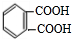 ;DEHP的结构简式是
;DEHP的结构简式是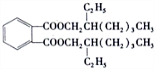 ;
;