题目内容
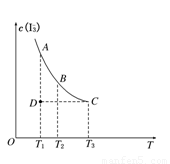
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq) I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是(
)
I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是(
)
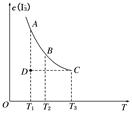
A.该反应的正反应是吸热反应 B.在反应进行到D点时,v正>v逆
C.A点与C点的化学反应速率vA<vC D.A点与B点相比,B点的c(I2)大
【答案】
A
【解析】
试题分析:由图可知,温度越高,I的平衡浓度越低,故正反应是放热反应,A错
D点时I浓度低于平衡浓度,故v正>v逆,B对
温度越高,反应速率越快,T1<T2,故vA<vC,C对
从A到B平衡向逆向移动,故B点的c(I2)大,D对
考点:影响化学反应速率的因素和化学平衡的移动
点评:该题结合图像考查化学反应速率和平衡的相关问题,考查学生的读图能力,注意图像中的起点,拐点和曲线的变化趋势,难度一般

练习册系列答案
相关题目
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq) I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( )
I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),不正确的是( ) 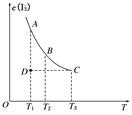
| A.该反应的正反应是吸热反应 | B.在反应进行到D点时,v正>v逆 |
| C.A点与C点的化学反应速率vA<vC | D.A点与B点相比,B点的c(I2)大 |
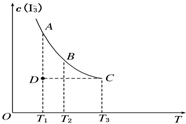 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I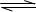 I2(aq)+I-(aq)
I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是
(
)
I2(aq)+I-(aq)
I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是
(
)
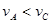
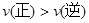
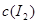 大
大 I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是
I(aq),上述平衡体系中,I的物质的量浓度c(I)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是