题目内容
【题目】下列选项中不正确的是 ![]()
A.等物质的量浓度的下列溶液中![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 由大到小的顺序是
由大到小的顺序是![]()
B.![]() 时,
时,![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合,若
混合,若![]() ,则混合溶液的pH一定小于7
,则混合溶液的pH一定小于7
C.室温下,向![]() 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性:![]()
D.对于反应![]()
![]() ,理论上在任何温度下都能自发进行
,理论上在任何温度下都能自发进行
【答案】B
【解析】
A项,![]() 是弱电解质,电离产生的
是弱电解质,电离产生的![]() 最少,其他三种盐中,
最少,其他三种盐中,![]() 的水解会抑制
的水解会抑制![]() 的水解,
的水解,![]() 的水解会促进
的水解会促进![]() 的水解,而
的水解,而![]() 对
对![]() 的水解无影响,故四种等浓度的溶液中,
的水解无影响,故四种等浓度的溶液中,![]() 由大到小的顺序是
由大到小的顺序是![]() ,正确;
,正确;
B项,若![]() 比
比![]() 大很多,混合溶液的pH小于7,若
大很多,混合溶液的pH小于7,若![]() 比
比![]() 大的不多,混合溶液的pH可能会大于7,错误;
大的不多,混合溶液的pH可能会大于7,错误;
C项,反应后溶液中的溶质有![]() 、
、![]() 、
、![]() ,其中,
,其中,![]() 的物质的量最多、
的物质的量最多、![]() 最少,正确;
最少,正确;
D项,该反应是一个焓减、熵增的反应,由![]() 可知,
可知,![]() ,故理论上在任何温度下都能自发进行,正确。
,故理论上在任何温度下都能自发进行,正确。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
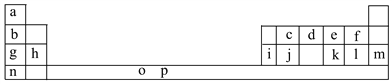
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___________________。
(2)d与a反应的产物的分子中中心原子的杂化形式为__________,该分子是__________(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是__________________________________________________;
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
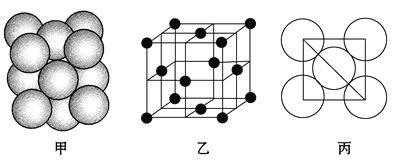
请回答:
①晶胞中i原子的配位数为________,一个晶胞中i原子的数目为________。