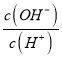��Ŀ����
����Ŀ��ȫ����ʮ�컷����ѧ�����2019��8��15��������ٿ�������һ����������Ϊ����ɽ��������Ⱦ������������ͭ�����ھ��ж��صĹ�ѧ����ѧ����ѧ����ѧ���ʶ���Ϊ�Ʊ������Ե���缫���������ϡ�ij��ͭ��������Ҫ�ɷ�ΪCu��Cu2Se��Cu2Te���г�����ͭ������Se�����ڣ�Te���⣬���������������������Ԫ���������������
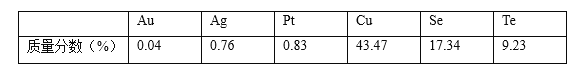
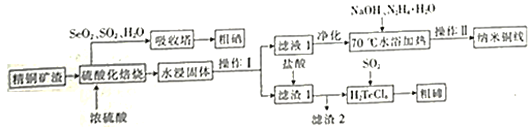
����ͭ�ߵ��Ʊ��������ڵ���Ҫ����������ͼ��
(1)16S��34Se��52TeΪͬ����Ԫ�أ�����52Te��Ԫ�����ڱ��е�λ��Ϊ______��
(2)�������ữ���գ�Cu��Cu2Se��Cu2Teת��ΪCuSO4��SeO2��TeO2������Cu2Te���ữ���յĻ�ѧ����ʽΪ______��
(3)�������ڷ����ķ�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ______��
(4) ��ˮ�������������в��������Ȼ��ƹ��壬�ɼ��ٹ����е�������������Һ1�У���ƽ���ƶ�ԭ���ǶȽ�����ԭ��______��
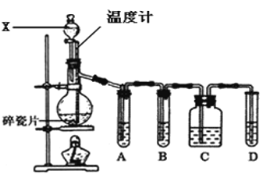
(5) ��70��ˮԡ������ʱ������Ӧ�����ӷ���ʽΪ______��ˮԡ���ȶ�ʱ�����Һ�г�����״������ȹ��ˣ���ˮϴ������______ϴ�ӡ�������Եõ�����ͭ�ߡ�
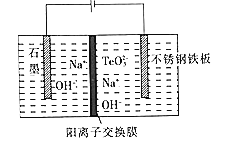
(6)Ŀǰ�ڻ��ӱ�Ĥ̫������ҵ��չѸ�٣�����Ϊ�����з�չǰ����̫���ܼ���֮һ�� �о������ڵ͵����ܶȼ��Ե������¡�����TeO32-��Ũ�ȣ����Դٽ�Te�ij�����Te �����ĵ缫��ӦʽΪ______������Na+��______������ʯ ī��������������������缫�ƶ���
���𰸡�����������A�� Cu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O 1:2 ���ڴ���ƽ�⣺Ag2SO4(s)
2CuSO4+TeO2+4SO2��+6H2O 1:2 ���ڴ���ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���� 2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O) ��ˮ�Ҵ� TeO32-+4e-+3H2O==Te+6OH- ���������
2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���� 2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O) ��ˮ�Ҵ� TeO32-+4e-+3H2O==Te+6OH- ���������
��������
(1) 52Te��16S��34Seͬ���壬����Ӳ���Ϊ5������������Ϊ6���ɴ˿�ȷ������Ԫ�����ڱ��е�λ�á�
(2)Cu2Te�������ữ���գ�ת��ΪCuSO4��TeO2�������ᱻ��ԭΪSO2�ȡ�
(3)�������ڷ���SeO2��SO2��H2O��������ԭ��Ӧ��SeO2����������ת��ΪSe��SO2����ԭ����ת��ΪH2SO4���ɴ˿�����������뻹ԭ�������ʵ���֮�ȡ�
(4) ��ˮ�������������д�������ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)������AgCl���ɼ��ٹ����е�������������Һ1�С�
2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)������AgCl���ɼ��ٹ����е�������������Һ1�С�
(5) ��70��ˮԡ������ʱ,CuSO4��NaOH��N2H4H2O����������ԭ��Ӧ������Cu�ȡ�ϴ����״������Ա�õ�����ͭ�ߣ�����ʱ��Ӧע���ֹͭ��������
(6)����TeO32-��Ũ�ȣ����Դٽ�Te�ij�����Te ����ʱ����TeO32-ת��ΪTe���ڵ����У��������������ƶ����Ӷ�ȷ��Na+�ƶ��ķ���
(1) 52Te��16S��34Seͬ���壬����Ӳ���Ϊ5������������Ϊ6���Ӷ�ȷ��52Teλ�ڵ���������A�塣��Ϊ������������A�壻
(2)Cu2Te�������ữ���գ�ת��ΪCuSO4��TeO2�������ᱻ��ԭΪSO2�ȣ��Ӷ��ó���Ӧ�Ļ�ѧ����ʽΪCu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O����Ϊ��Cu2Te+6H2SO4(Ũ)
2CuSO4+TeO2+4SO2��+6H2O����Ϊ��Cu2Te+6H2SO4(Ũ)![]() 2CuSO4+TeO2+4SO2��+6H2O��
2CuSO4+TeO2+4SO2��+6H2O��
(3)�������ڷ���SeO2��SO2��H2O��������ԭ��Ӧ��SeO2����������ת��ΪSe��SO2����ԭ����ת��ΪH2SO4��������Ӧ�Ļ�ѧ����ʽΪSeO2+2SO2+2H2O==Se+2H2SO4���ɴ˵ó��������뻹ԭ�������ʵ���֮��Ϊ1:2����Ϊ��1:2��
(4) ��ˮ�������������д�������ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)�����ɸ����ܵ�AgCl���ɼ��ٹ����е�������������Һ1�С���Ϊ�����ڴ���ƽ�⣺Ag2SO4(s)
2Ag+(aq)+SO42-(aq)�����������Ȼ��ƹ��壬�Ӷ�������Һ�е�c(Cl-)�����ɸ����ܵ�AgCl���ɼ��ٹ����е�������������Һ1�С���Ϊ�����ڴ���ƽ�⣺Ag2SO4(s)![]() 2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��span>Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���У�
2Ag+(aq)+SO42-(aq)�������Ȼ��ƹ����Cl-��span>Ag+��Ӧ���ɸ����ܵ��Ȼ�����ʹ��c(Ag+)���ͣ�����������������������Һ���У�
(5) ��70��ˮԡ������ʱ,CuSO4��NaOH��N2H4H2O����������ԭ��Ӧ������Cu�ȣ�������Ӧ�����ӷ���ʽΪ2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O)��ϴ����״������Ա�õ�����ͭ�ߣ�����ʱ��Ϊ��ֹͭ��������Ӧʹ���Ҵ�ϴ�ӡ���Ϊ��2Cu2++4OH-+N2H4H2O==2Cu��+N2��+5H2O(��2Cu2++4OH-+N2H4 ==2Cu��+N2��+4H2O)���Ҵ���
(6) Te ����ʱ����TeO32-ת��ΪTe�����ڼ��Ի����У��缫��ӦʽΪTeO32-+4e-+3H2O==Te+6OH-����ͼ�п��Կ��������Դ����������ʯīΪ���������Դ���������IJ��������Ϊ���������ʱ����Һ�е��������������ƶ�����Na+����������塣��Ϊ��TeO32-+4e-+3H2O==Te+6OH-����������塣

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�