题目内容
【题目】碳是构成物质世界最重要的元素之一,能形成众多的化合物。
(1)已知0.096kg碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量。
①2H2(g)+O2(g)=2H2O(l) H=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g) H=-566kJmol-1
请写出制备水煤气的热化学方程式_______________________。
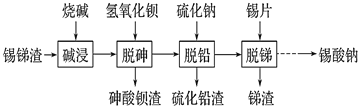
(2)为研究CO2与CO之间的转化。让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:
2CO(g) H。测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示:

回答下列问题:
①p1、p2、p3的大小关系是__________,图中a、b、c三点对应的平衡常数大小关系是__________(用Ka、Kb、Kc表示)。
②一定条件下,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K=_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3 kJmol-1 p1<p2<p3 Ka=Kb<Kc ![]() 50% 不变
50% 不变
【解析】
(1)根据盖斯定律计算;
(2)①方程中左边气体计量数小于右边,根据勒夏特列原理判断;
②根据三段式计算。
(1)0.096kg碳即8mol碳完全燃烧可放出3148kJ热量,1mol液态水汽化时要吸收44kJ热量,则③C(s) +O2(g)=CO2(g) H=-393.5 kJmol-1,④H2O(g)=H2O(l) H=-44 kJmol-1,根据盖斯定律,③+④-![]() ×(①+②)可得C(s)+H2O(g)=CO(g)+H2(g),ΔH=[-393.5-44-
×(①+②)可得C(s)+H2O(g)=CO(g)+H2(g),ΔH=[-393.5-44-![]() ×(-566-571.6)]kJ/mol=+131.3 kJmol-1;
×(-566-571.6)]kJ/mol=+131.3 kJmol-1;
(2)①方程中左边气体计量数小于右边,根据勒夏特列原理,压强越大,CO的百分含量则越小,根据图像可判断温度相同时,p3时CO的百分含量最小,则p1<p2<p3;根据图像,升高温度CO的百分含量增大,升高温度平衡正向移动,则K增大,K只与温度有关,Ka=Kb<Kc;
②
则K=![]() =
=![]() ;若开始时充入2 mol CH3OH(g)和2 mol H2O(g)达到相同平衡状态时,温度未变,则K不变,则与原平衡等效,达到平衡状态时,CH3OH的物质的量为1mol,则转化率为50%;若平衡后再充入4 mol的N2,平衡不移动,则c(CO2)和原平衡浓度相等。
;若开始时充入2 mol CH3OH(g)和2 mol H2O(g)达到相同平衡状态时,温度未变,则K不变,则与原平衡等效,达到平衡状态时,CH3OH的物质的量为1mol,则转化率为50%;若平衡后再充入4 mol的N2,平衡不移动,则c(CO2)和原平衡浓度相等。