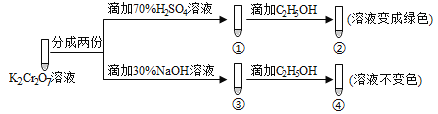
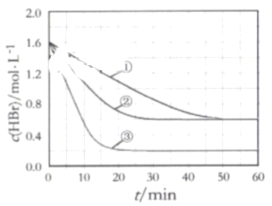
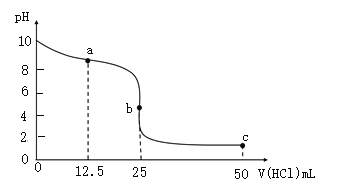
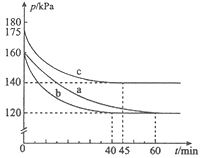
题目内容
【题目】工业上用饱和电解食盐水来制取氯气.现取500mL含NaCl为11.7g的饱和食盐水进行电解.(已知2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-)
Cl2↑+ H2↑+ 2OH-)
(1) 在标准状况下制得Cl2多少升?
(2) 所得NaOH的物质的量浓度为多少?(电解前后溶液体积保持不变)
【答案】根据题意,NaCl物质的量n=m/M=11.7/58.5=0.2mol,
设电解过程生成氯气的物质的量为y,生成氢氧化钠的物质的量为x, 电解饱和食盐水:2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-反应可知:反应消耗0.2molNaCl,生成氢氧化钠0.2mol,生成氯气0.1mol;
Cl2↑+ H2↑+ 2OH-反应可知:反应消耗0.2molNaCl,生成氢氧化钠0.2mol,生成氯气0.1mol;
(1)标准状况下制得Cl2体积V=Vm×22.4=0.1×22.4=2.24L;
(2)据c=n/V=0.2/0.5=0.4mol/L;
【解析】
(1)根据电解方程式和氯化钠的量进行计算出氯气的量,从而计算出氯气的体积;
(2)根据电解方程式来计算所得氢氧化钠的物质的量,据c=![]() 计算其浓度。
计算其浓度。
根据题意,NaCl物质的量n=m/M=11.7/58.5=0.2mol,
设电解过程生成氯气的物质的量为y,生成氢氧化钠的物质的量为x, 电解饱和食盐水:2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-反应可知:反应消耗0.2molNaCl,生成氢氧化钠0.2mol,生成氯气0.1mol;
Cl2↑+ H2↑+ 2OH-反应可知:反应消耗0.2molNaCl,生成氢氧化钠0.2mol,生成氯气0.1mol;
(1)结合以上分析可知,标准状况下制得Cl2体积V=nVm=0.1mol×22.4L/mol=2.24L;
答:在标准状况下制得氯气2.24L;
(2) 结合以上分析可知,生成氢氧化钠0.2mol,据c=![]() =
=![]() =0.4mol/L;
=0.4mol/L;
答:所得NaOH的物质的量浓度为0.4mol/L。

练习册系列答案
相关题目