题目内容
2.碲锌镉(Te-Zn-Cd)晶体可以用于制造红外探测器的基础材料,下列有关它的叙述中不正确的是( )| A. | 它是由Te、Zn、Cd按一定比例混合而成的,无固定的溶沸点 | |
| B. | 它易导电、导热,具有延展性 | |
| C. | 它的熔、沸点比Zn的低 | |
| D. | 它的硬度和强度比Cd的大 |
分析 合金是指在一种金属中加热熔合其它金属或非金属而形成的具有金属特性的物质;合金具有以下特点强度和硬度一般比组成他们的纯金属高,抗腐蚀性强,熔点比成分金属熔点低,具有导电、导热和延展性.
解答 解:A.依据题干材料可知,碲锌镉(Te-Zn-Cd)晶体是由Te、Zn、Cd按一定比例融合而成的混合物,不是简单的混合,无固定的熔沸点,故A错误;
B.合金具有导电、导热和延展性,故B正确;
C.合金的熔点比成分金属熔点低,故C正确;
D.合金硬度一般比组成他们的纯金属高,故D正确;
故选A.
点评 本题考查了合金知识,明确合金的概念和性能是解题关键,注意合金的硬度和熔点规律,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.钠多以资源丰富的NaCl为原料来制备,下列方法中能够制备出金属钠的是( )
| A. | 加热NaCl晶体 | B. | 用金属钾与NaCl溶液反应 | ||
| C. | 电解NaCl溶液 | D. | 电解熔融的NaCl |
13.分离和提纯物质的方法不仅用于实验研究而且广泛应用于工业生产和生活实际.
(1)海水晒盐过程中,采用蒸发方法可得到粗盐固体;将粗盐固体溶解后,为去除其中的泥沙应采用的方法是过滤.
粗盐中除泥沙外还含有可溶性杂质(如下表所示),可按下表所示顺序依次除去(将表格填写完整).
依次加入上述试剂后,再加入适量稀盐酸可除去上述步骤引入的杂质离子
(2)利用海水各组分沸点不同获得淡水的方法是蒸馏.
(3)从海带中可提取碘单质.用萃取的方法可将碘单质从水溶液中提取出来该方法利用了I2在不同溶剂中的溶解性不同.
(1)海水晒盐过程中,采用蒸发方法可得到粗盐固体;将粗盐固体溶解后,为去除其中的泥沙应采用的方法是过滤.
粗盐中除泥沙外还含有可溶性杂质(如下表所示),可按下表所示顺序依次除去(将表格填写完整).
| 杂质 | 加入试剂的化学式 |
| 硫酸盐 | BaCl2 |
| MgCl2 | NaOH |
| CaCl2 | Na2CO3 |
(2)利用海水各组分沸点不同获得淡水的方法是蒸馏.
(3)从海带中可提取碘单质.用萃取的方法可将碘单质从水溶液中提取出来该方法利用了I2在不同溶剂中的溶解性不同.
10.H2O2是一种弱酸,在强碱性溶液中主要以HO2-形式存在,现以Al-H2O2燃料电池为电源,采用电化学法还原CO2,图是利用此法制备ZnC2O4的装置图(电解液不参与反应),下列说法正确的是( )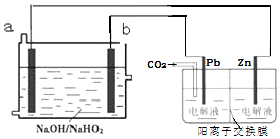

| A. | a为电源的负极 | |
| B. | 阴极的电极反应式为2CO2+2e-═C2O42- | |
| C. | 电解过程中电子的流向为b→Pb→Zn→a | |
| D. | a电极每消耗1mol HO2-,同时可制得0.5molZnC2O4 |
17. 光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
 光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )
光能储存一般是指将光能转换为电能或化学能进行储存,利用太阳光、CO2、H2O生成甲醇的光能储存装置如图所示,制备开始时质子交换膜两侧的溶液质量相等.下列叙述不正确的是( )| A. | n型半导体为负极 | |
| B. | X2为O2,H+由b极向a极移动 | |
| C. | b极的电极反应式为CO2+6e-+6H+=CH3OH+H2O | |
| D. | 当制备32g甲醇时,质子交换膜两侧溶液相差104g |
2.向盛有1mL 0.1mol•L-1MgCl2溶液的试管中滴加1mL 0.2mol•L-1氨水,观察到有白色沉淀生成,再滴加1mL 0.1mol•L-1FeCl3溶液,发现白色沉淀转化为红褐色沉淀.由以上现象可以推知,下列叙述不正确的是( )
| A. | 白色沉淀转化为红褐色沉淀的离子方程式是:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| B. | 上述实验说明:Mg(OH)2的KSP大于Fe(OH)3的KSP | |
| C. | 最后所得溶液中:c (Cl-)=c (NH4+)+2c (Mg2+)+3c (Fe3+) | |
| D. | 最后所得溶液中:c (Cl-)>c (NH4+)>c (Mg2+)>c (Fe3+) |
9.在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2mol A和1mol B,发生反应:2A(g)+B(g)?2D(g)△H=Q kJ•mol-1.相关条件和数据见下表:下列说法正确的是( )
| 实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应温度/℃ | 700 | 700 | 750 |
| 达平衡时间/min | 40 | 5 | 30 |
| n(D)平衡/mol | 1.5 | 1.5 | 1 |
| 化学平衡常数 | K1 | K2 | K3 |
| A. | K3>K2=K1 | |
| B. | 实验Ⅱ可能使用了催化剂 | |
| C. | 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的$\frac{9}{10}$倍 | |
| D. | 实验Ⅲ达平衡后,恒温下再向容器中通入1 mol A和1 mol D,平衡不移动 |
6.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 反应6NaBH4+2FeC13+18H2O=2Fe+6NaCl+6H3BO3+21H2↑可制纳米铁,该反应中每生成1 mol Fe,转移的电子数目为3NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧后生成的CO2分子数为NA | |
| C. | 1mol氯气与过量铁反应,转移的电子数为3NA | |
| D. | 30g甲酸甲酯与葡萄糖的混合物中含有的原子数为4NA |