题目内容
14.有关甲、乙、丙、丁四个图示的叙述正确的是( )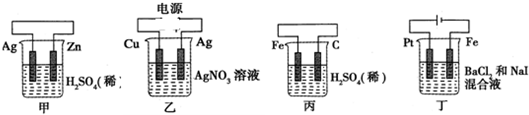
| A. | 甲中负极反应式为:Ag-e-=Ag+ | |
| B. | 乙中阳极反应式为:Cu-2e-=Cu2+ | |
| C. | 丙中H+向碳棒方向移动 | |
| D. | 丁中电解开始时阳极产生黄绿色气体 |
分析 A.甲为原电池,Zn易失电子作负极、Ag作正极;
B.乙为电解池,Ag作阳极、Cu作阴极,阳极上银失电子发生氧化反应;
C.丙为原电池,Fe易失电子作负极、C作正极,电解质溶液中阳离子向正极移动;
D.丁为电解池,Pt为阳极、Fe为阴极,阳极上碘离子失电子发生氧化反应.
解答 解:A.甲为原电池,Zn易失电子作负极、Ag作正极,负极反应式为Zn-2e-═Zn2+,故A错误;
B.乙为电解池,Ag作阳极、Cu作阴极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-═Ag+,故B错误;
C.丙为原电池,Fe易失电子作负极、C作正极,电解质溶液中阳离子向正极移动,所以丙中H+向碳棒方向移动,故C正确;
D.丁为电解池,Pt为阳极、Fe为阴极,阳极上碘离子失电子发生氧化反应,所以丁中电解开始时阳极产生红棕色气体,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应即可解答,知道离子移动方向,注意电解池阳极材料是活泼金属时发生的电极反应,注意D中阴离子还原性强弱顺序,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | NA个CO2分子占有的体积一定为22.4L | |
| B. | 标准状况下,22.4L四氯化碳含有的分子数为NA | |
| C. | 常温常压下,1.06g Na2CO3含有的Na+数为0.02 NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含Cl-个数为NA |
9.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | Na2Ca | C. | Si02 | D. | CaC03 |
6.100mL 2mol•L-l硫酸跟过量的锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硝酸钾 | B. | 醋酸钠 | C. | 硫酸氢钠 | D. | 硫酸铜 |
3.煤的干馏和石油的分馏两种变化在本质上的差别是( )
| A. | 加热的温度不同 | B. | 得到的产品不同 | ||
| C. | 前者要隔绝空气,后者不必 | D. | 干馏是化学变化,分馏是物理变化 |
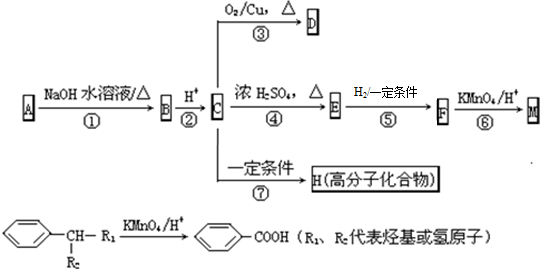
 .
.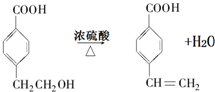 反应⑦的化学方程式为
反应⑦的化学方程式为 .
.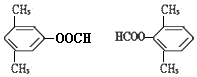 .
.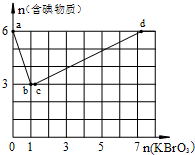 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示. 有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系:
有A、B、C、D、E、F六种微粒,其中A~E五种微粒均由两种元素组成且均含10个电子,它们有如图所示的转化关系: