题目内容
2.下列说法正确的是( )| A. | 某溶液与NaOH 溶液共热,产生使湿润的红色石蕊试纸变蓝色的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入AgNO3 溶液时,产生白色沉淀,说明原溶液中一定存在Cl- | |
| C. | 某溶液中滴加BaCl2 溶液时,产生白色沉淀,说明原溶液中一定存在SO42- | |
| D. | 焰色反应中火焰显黄色,说明样品中存在钠元素,不存在钾元素 |
分析 A、使湿润的红色石蕊试纸变蓝色的气体为氨气,铵盐可以和氢氧化钠之间反应产生氨气;
B、能和硝酸银反应产生白色沉淀的可以是硫酸根离子、碳酸根离子或是氯离子;
C、和氯化钡反应产生的白色沉淀可以是硫酸钡还可以是氯化银;
D、钠元素的焰色反应是黄色的,钾元素的焰色反应需要透过钴玻璃观察才是呈现紫色的.
解答 解:A、使湿润的红色石蕊试纸变蓝色的气体为氨气,铵盐可以和氢氧化钠之间反应产生氨气,某溶液与NaOH 溶液共热,产生使湿润的红色石蕊试纸变蓝色的气体,说明原溶液中存在NH4+,故A正确;
B、某溶液中加入AgNO3 溶液时,产生白色沉淀,说明原溶液中可能存在硫酸根离子、碳酸根离子或是氯离子,故B错误;
C、和氯化钡反应产生的白色沉淀可以是硫酸钡还可以是氯化银,某溶液中滴加BaCl2 溶液时,产生白色沉淀,说明原溶液中一定存在SO42-或是氯离子,故C错误;
D、焰色反应中火焰显黄色,说明样品中存在钠元素,不能确定是否含有钾元素,故D错误.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子的检验、氧化还原反应等,把握物质的性质及发生的反应为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
5.某有机物链状分子中含n个-CH2-,m个 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
 ,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )
,a个-CH3,其余为-Cl.则该有机物分子中Cl的个数为( )| A. | m+n+a | B. | m+2-a | C. | 2n+3m-a | D. | m+2n+2-a |
6.下列各组物质中,X是主体物质,Y是少量杂质,Z是除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( ) 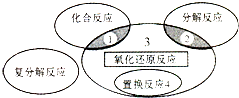

| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | D. | Zn+H2SO4═ZnSO4+H2↑ |
7.20g A物质和14g B物质恰好完全反应,生成8.8g C物质、3.6g D物质和标准状况下4.48L气体E,则E物质的摩尔质量为( )
| A. | 100g/mol | B. | 108g/mol | C. | 55g/mol | D. | 96g/mol |
11.已知糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.请结合题意回答问题:
(1)燃料乙醇的生产过程可表示如下:玉米→粉碎→水解→发酵→过滤→a→乙醇
①粉碎玉米的目的是增大反应物的接触面积或加快反应速率或使反应充分进行.
②生产过程中若想证明淀粉部分水解的实验方法是取少许水解后的液体分别置于两试管中,一支加入氢氧化钠溶液使其pH大于7,再加入新制的氢氧化铜悬浊液,加热,产生砖红色沉淀,证明淀粉发生了水解,产生葡萄糖;另一支加入少量碘水,碘水变蓝,证明还有未水解的淀粉存在.
③步骤a的操作是C.
A.蒸发 B.萃取 C.蒸馏 D分液.
(2)除去下列物质中的少量杂质(括号内为杂质),试填下表
(3)根据三种营养物质的性质,判断下列说法正确的是B.
A.蔗糖和麦芽糖互为同分异构体,二者均能与银氨溶液反应,并且水解产物相同.
B.盐析可提纯蛋白质并保持其生理活性.
C.天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点.
D.两分子半胱氨酸(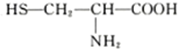 )脱水缩合形成二肽的结构简式为:
)脱水缩合形成二肽的结构简式为: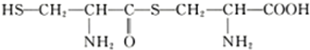 .
.
(4)写出工业上由硬脂酸甘油酯制肥皂的化学方程式: +3NaOH $\stackrel{加热}{→}$3C17H35COONa+
+3NaOH $\stackrel{加热}{→}$3C17H35COONa+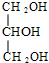 .
.
(1)燃料乙醇的生产过程可表示如下:玉米→粉碎→水解→发酵→过滤→a→乙醇
①粉碎玉米的目的是增大反应物的接触面积或加快反应速率或使反应充分进行.
②生产过程中若想证明淀粉部分水解的实验方法是取少许水解后的液体分别置于两试管中,一支加入氢氧化钠溶液使其pH大于7,再加入新制的氢氧化铜悬浊液,加热,产生砖红色沉淀,证明淀粉发生了水解,产生葡萄糖;另一支加入少量碘水,碘水变蓝,证明还有未水解的淀粉存在.
③步骤a的操作是C.
A.蒸发 B.萃取 C.蒸馏 D分液.
(2)除去下列物质中的少量杂质(括号内为杂质),试填下表
| 物质 | 加入试剂 | 去杂提纯方法 |
| 蛋白质(NaCl) | ||
| 肥皂(甘油) |
A.蔗糖和麦芽糖互为同分异构体,二者均能与银氨溶液反应,并且水解产物相同.
B.盐析可提纯蛋白质并保持其生理活性.
C.天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点.
D.两分子半胱氨酸(
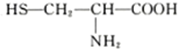 )脱水缩合形成二肽的结构简式为:
)脱水缩合形成二肽的结构简式为: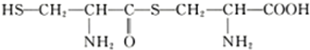 .
.(4)写出工业上由硬脂酸甘油酯制肥皂的化学方程式:
 +3NaOH $\stackrel{加热}{→}$3C17H35COONa+
+3NaOH $\stackrel{加热}{→}$3C17H35COONa+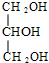 .
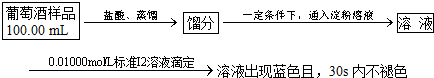
. 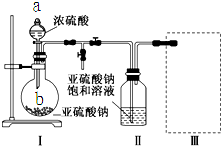 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: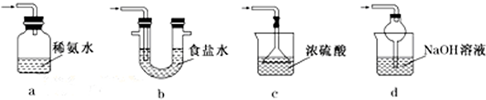

 2C(g)+B(g)△H=+100akJ/mol.
2C(g)+B(g)△H=+100akJ/mol.