题目内容
碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态锗原子外围电子排布式为 .
(2)在第二周期中,第一电离能位于硼元素与氮元素之间的元素有 种.
参照图1、图2和图3,分别同答(3)、(4)小题.

(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似.每个冰晶胞平均占有 个水分子,冰晶胞与金刚石晶胞排列方式相同的原因是 .
(4)C60的晶体为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,计算C60晶体的密度为 g/cm3.
(1)锗(Ge)是用途很广的半导体材料,基态锗原子外围电子排布式为
(2)在第二周期中,第一电离能位于硼元素与氮元素之间的元素有
参照图1、图2和图3,分别同答(3)、(4)小题.

(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似.每个冰晶胞平均占有
(4)C60的晶体为面心立方堆积,已知晶胞中C60分子间的最短距离为d cm,计算C60晶体的密度为
考点:晶胞的计算,原子核外电子排布,元素电离能、电负性的含义及应用
专题:
分析:(1)Ge是32号元素,与硅同主族,核外电子数为32,根据构造原理书写其基态原子核外电子分布式;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(3)根据晶胞结构图利用均摊法计算,水中的氧和金刚石中的碳的杂化方式相同,氢键和共价健都有方向性和饱和性,据此解释;
(4)根据晶胞结构确定晶胞中含有C60分子的个数,再根据ρ=
计算密度;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(3)根据晶胞结构图利用均摊法计算,水中的氧和金刚石中的碳的杂化方式相同,氢键和共价健都有方向性和饱和性,据此解释;
(4)根据晶胞结构确定晶胞中含有C60分子的个数,再根据ρ=
| m |
| V |
解答:
解:(1)Ge是32号元素,与硅同主族,核外电子数为32,基态原子外围电子分布式为:4s24p2,
故答案为:4s24p2;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以在第二周期中,第一电离能位于硼元素与氮元素之间的元素有B、C、O三种,
故答案为:3;
(3)根据晶胞结构图可知,每个晶胞中含有水分子数为4+8×
+6×
=8,水中的氧和金刚石中的碳原子都是sp3杂化,每个水分子与相邻的4个水分子形成氢键,且氢键具有方向性和饱和性,所以冰晶胞与金刚石晶胞排列方式相同,
故答案为:8;水中的氧和金刚石中的碳原子都是sp3杂化,每个水分子与相邻的4个水分子形成氢键,且氢键具胡方向性和饱和性;
(4)C60的晶体为面心立方堆积,所以每个晶胞中含有C60分子的个数为8×
+6×
=4,晶胞中C60分子间的最短距离为d cm,则晶胞的边长为
d cm,所以C60晶体的密度为
g/cm3=
g/cm3,
故答案为:
;
故答案为:4s24p2;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,所以在第二周期中,第一电离能位于硼元素与氮元素之间的元素有B、C、O三种,
故答案为:3;
(3)根据晶胞结构图可知,每个晶胞中含有水分子数为4+8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:8;水中的氧和金刚石中的碳原子都是sp3杂化,每个水分子与相邻的4个水分子形成氢键,且氢键具胡方向性和饱和性;
(4)C60的晶体为面心立方堆积,所以每个晶胞中含有C60分子的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 2 |
| ||
(
|
720
| ||
| NAd3 |
故答案为:
720
| ||
| NAd3 |
点评:本题主要考查核外电子排布规律、电离能、晶胞结构与晶胞计算等,本题基础性较强,重点特出,注意利用均摊法进行常见晶胞结构的分析.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
我国科学家制得了SiO2超分子纳米管,微观结构如图.下列叙述正确的是( )


| A、SiO2与干冰的晶体结构相似 |
| B、SiO2耐腐蚀,不与任何酸反应 |
| C、工业上用SiO2制备粗硅 |
| D、光纤主要成分是SiO2,具有导电性 |
下列有关实验装置进行的相应实验,不能达到实验目的是( )
A、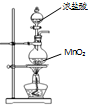 用装置制取氯气 |
B、 用装置除去氯气中的少量氯化氢和水蒸气 |
C、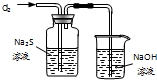 用装置可证明Cl2的氧化性强于S |
D、 用装置可以完成“喷泉”实验 |
下列关于苯酚的叙述中,不正确的是( )
| A、其浓溶液如果不慎沾在皮肤上,应立即用酒精擦洗 |
| B、其水溶液显强酸性,俗称石炭酸 |
| C、超过65℃可以与水以任意比互溶 |
| D、纯净的苯酚是无色晶体,在空气中易被氧化而呈粉红色 |

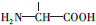 b.在稀硫酸中水解有乙酸生成
b.在稀硫酸中水解有乙酸生成

 ,请写出其涉及的反应(注明反应的条件
,请写出其涉及的反应(注明反应的条件 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.