��Ŀ����
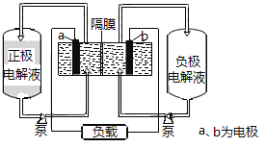
����Ŀ��I����ͼ��ȫ��Һ����ص�ʾ��ͼ
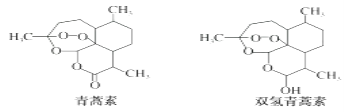
�õ�س�ŵ���ܷ�ӦʽΪ��![]()
��ش��������⣺
��1�����ʱ��������ӦʽΪ______________������������ɫ�仯��______��
��2���ŵ�����У�����������Һ��pH ________��ѡ��������������������������������
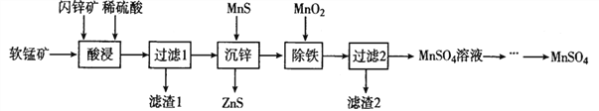
II���������÷Ϸ���������Ҫ�ɷ�ΪV2O5��VOSO4�Ͷ������裩�Ĺ�����������ͼ��ʾ��
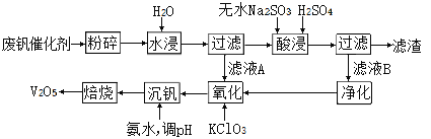
��3������������______________________����һ����;����
��4��25��ʱ��ȡ������ʵ��������õ��������ʺ���ҺpH֮��Ĺ�ϵ���±���ʾ��
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
�������ʣ����� | 88.1 | 91.8 | 96.5 | 98 | 99.8 | 97.8 | 96.4 | 93.0 | 89.3 |
�����ϱ������жϣ����백ˮ��������ԣ���Һ�����pHΪ____��
��5��Ϊ����߷��Ľ����ʣ������ʹ�Ϸ������е�V2O5ת��ɿ�����ˮ��VOSO4����������У���������ͻ�ԭ��������ʵ���֮��Ϊ________��
��6�����������У�VO2+��ΪVO2+����÷�Ӧ�����ӷ���ʽΪ____________________��
���𰸡�V3++e![]() V2+ ��ɫ���ɫ ���� �������ά���������ϵ� 1.7 1��2 ClO3+6VO2++3H2O
V2+ ��ɫ���ɫ ���� �������ά���������ϵ� 1.7 1��2 ClO3+6VO2++3H2O![]() 6VO2++Cl+6H+
6VO2++Cl+6H+
��������
I����1�����ʱ������������ԭ��Ӧ����������������Ӧ�����ݵ��ԭ�����з�����
��2���ɵ���ܷ�Ӧд���ŵ�ʱ��������Ӧ���ݴ˷�������������Һ�����Ա仯������
II���Ϸ������ɷ�ΪV2O5��VOSO4�Ͷ���������������ˮ��ˮ������ˣ��������ʵ�ˮ���Կ���ȷ��V2O5�Ͷ�������������ˮ����Ϊ����������������л�ԭ�������������������ܹ�����������������������������������ӷ�ӦΪ��V2O5+SO32-+4H+=2VO2++ SO42-+2H2O�����˵õ���ҺB�����������ҺA��ϼ�������أ�����ؾ��������ԣ��ܹ���VO2+����ΪVO2+�����백ˮ��������Һ��pH�����ֵ���õ�NH4VO3������յõ������������������Ϸ��������
I����1�����ʱ������������ԭ��Ӧ����V3+�õ�������V2+���缫��ӦΪ��V3++e![]() V2+�����ʱ����������������Ӧ��VO2+-e+H2O=VO2++2H+����Һ����ɫ����ɫ��Ϊ��ɫ��
V2+�����ʱ����������������Ӧ��VO2+-e+H2O=VO2++2H+����Һ����ɫ����ɫ��Ϊ��ɫ��
�������������������V3++e =V2+����ɫ���ɫ��
��2���ŵ����Ϊԭ��أ�������ӦΪ��ԭ��Ӧ���ɵ���ܷ�Ӧ��֪���ŵ�ʱ��������ӦΪ��VO2++2H++e =VO2++H2O������������Һ�����Լ�����pH������
�������������������������
II����3������������Ϊ�����������������������ά���������ϵ���
����������������ǣ��������ά���������ϵ���
��4����ͼ�з������ʺ���ҺpH֮��Ĺ�ϵ��֪�������백ˮ������Һ������ԣ���Һ�����pHΪ1.7ʱ���������������
�������������������1.7��
��5������������Ӿ��л�ԭ�����������������ܱ���������������������������������ӷ�ӦΪ��V2O5+SO32-+4H+=2VO2++SO42-+2H2O�����������������������ͻ�ԭ��������ʵ���֮��Ϊ1:2��
����������������ǣ�1:2��
��6�����������У�����ؾ������������ܽ�VO2+����ΪVO2+����������ԭΪCl���÷�Ӧ�����ӷ���ʽΪ��ClO3+6VO2++3H2O![]() 6VO2++Cl+6H+��
6VO2++Cl+6H+��
�������������������ClO3+6VO2++3H2O![]() 6VO2++Cl+6H+��
6VO2++Cl+6H+��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���������̺��ŷḻ����Դ�����ú�ˮ��ȡ��ˮ�����þ�IJ��ֹ�����ͼ��ʾ��
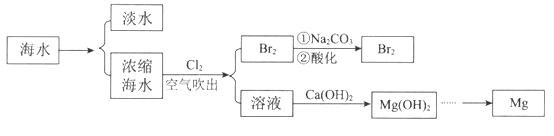
��1����ˮ�����ķ�����_________________�����ӽ������͵��������ȡ�
��2���ô�������Ũ����ˮ������Br2:
3Br2+ 6Na2CO3+3H2O�� 5NaBr+ NaBrO3+6NaHCO3��������3 mol Br2ʱ����Ӧ��ת�Ƶĵ�������_____________��
��3����ˮ�в������ӵĺ������£�
�ɷ� | ������ mg/L�� | �ɷ� | ������ mg/L�� |
Na+ | 10560 | Cl- | 18980 |
Mg2+ | 1272 | Br- | 64 |
Ca2+ | 400 | SO42- | 2560 |
���У�Mg2+�����ʵ���Ũ����____________����Ҫ��100 L�ĺ�ˮ����ȡþ����������Ҫ���������Ca��OH��2��������_______________��
��4����Mg��OH��2�Ƶ���Mg�����·�������ʵ���________________������ţ���
A��Mg��OH��2 ![]() MgO
MgO![]() Mg
Mg
B��Mg��OH��2![]() MgO
MgO![]() Mg
Mg
C��Mg��OH��2![]() ��ˮMgCl2
��ˮMgCl2![]() Mg
Mg
D��Mg��OH��2 ![]() MgCl2��Һ
MgCl2��Һ![]() Mg
Mg