题目内容
15.某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应).请回答下列问题:
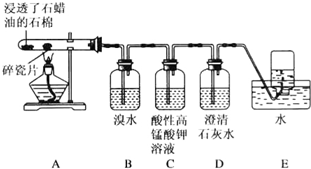
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃.例如,石油分馏产物之一的十六烷烃发生反应:C16H34$→_{△}^{催化剂}$C8H18+甲,甲$→_{△}^{催化剂}$4乙,则甲的分子式为C8H16,乙的结构简式为CH2=CH2.
(2)B装置中的实验现象可能是溴水褪色,写出反应的化学方程式:CH2=CH2+Br2→CH2Br-CH2Br,其反应类型是加成反应.
(3)C装置中可观察到的现象是高锰酸钾褪色,反应类型是氧化反应.
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳.根据本实验中装置D(填字母)中的实验现象可判断该资料是否真实.为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由:乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性.
(5)通过上述实验探究,检验甲烷和乙烯的方法是BC(选填字母,下同);除去甲烷中乙烯的方法是B.
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是乙烯含碳量高于甲烷.
分析 (1)依据原子个数守恒判断甲、乙物质,写出其分子式和结构简式;
(2)乙烯含有碳碳双键,能够与溴发生加成反应;
(3)乙烯具有还原性,能够被酸性高锰酸钾氧化;
(4)二氧化碳与氢氧化钙反应生成碳酸钙沉淀;乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
(5)甲烷性质稳定,乙烯含有C=C双键,能发生加成反应和氧化反应,可用溴水除杂,注意除杂时不能引入新的杂质;
(6)有机物含碳量越高,燃烧火焰越明亮,烟越浓.
解答 解:(1)石油裂化属于化学反应,遵循原子个数守恒,C16H34$→_{△}^{催化剂}$C8H18+甲,所以甲分子式为:C8H16;
依据方程式:C8H16$→_{△}^{催化剂}$4乙,结合原子个数守恒可知,乙为:C2H4,为乙烯,结构简式为:CH2=CH2;
故答案为:C8H16;CH2=CH2;
(2)乙烯含有碳碳双键,能够与溴发生加成反应而使溴水褪色,方程式为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:溴水褪色;CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
(3)乙烯具有还原性,能够被酸性高锰酸钾氧化发生氧化反应而使高锰酸钾褪色,
故答案为:高锰酸钾褪色;氧化反应;
(4)乙烯与酸性高锰酸钾溶液反应产生二氧化碳,二氧化碳能够与氢氧化钙反应生成碳酸钙沉淀,溶液变浑浊;
乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
故答案为:D;乙烯与溴若发生取代反应,则必然生成溴化氢,溴化氢溶于水显酸性;
(5)A.甲烷、乙烯不溶于水,且常温下与水都不反应,不能用于鉴别和除杂;
乙烯含有C=C双键,能与溴水发生加成反应生成二溴乙烷液体,甲烷不与溴水反应,所以可用溴水除去甲烷中混有的乙烯,可以鉴别甲烷与乙烯;
甲烷与高锰酸钾不反应,乙烯能够与高锰酸钾反应使其褪色,可以鉴别二者;但是乙烯被氧化生成和二氧化碳气体,不能用于除杂;
D.甲烷、乙烯都不溶于氢氧化钠溶液,不能用来鉴别和除杂;
故可用来鉴别的是:BC;可用来除杂的是:B;
故答案为:BC;B;
(6)乙烯含碳量高于甲烷,所以燃烧火焰明亮而伴有黑烟;
故答案为:乙烯含碳量高于甲烷.
点评 本题考查了乙烯的制备和性质的检验,熟悉裂化的原理及原子个数守恒规律、乙烯的性质是解题关键,题目难度不大.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | Na+、K+、Fe2+、Cl- | B. | K+、Fe3+、NO3-、Fe(OH)3(胶体) | ||
| C. | Cl-、SCN-、NH4+、葡萄糖分子 | D. | OH-、Na+、苯酚、Br - |
①MnO2+ZnS+2H2SO4$\frac{\underline{\;电解\;}}{\;}$MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$MnO2+Zn+2H2SO4.
下列说法中错误的是( )
| A. | 反应①中MnO2和H2SO4都是氧化剂 | |
| B. | 反应①中每析出12.8g S沉淀,转移0.8mol电子 | |
| C. | 金属锌也可用热还原法制备 | |
| D. | 硫酸在生产种可循环使用 |
| A. | 石油裂化的主要目的是为了提高轻质液体燃料的产量 | |
| B. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| C. | 冶炼铬可采用铝热法 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
(1)根据如表左边的“实验操作”,从右边的“实验现象”中选择正确的字母代号,填人对应“答案”的空格中.
| 实验操作 | 答案 | 实验现象 |
| ①向鸡蛋清溶液里加入饱和硫酸铵溶液 | A.呈蓝色 B.呈黄色 C、析出白色沉淀 D.出现光亮的银镜 | |
| ②向银氨溶液中加人葡萄糖溶液后水浴加热 | ||
| ③向鸡蛋清溶液里滴加浓硝酸后微热 | ||
| ④向士豆片上滴加碘水 |
①可以作为水果催熟剂的是D; ②富含乙醇的是C;
③在潮湿的空气中会生锈的是A; ④富含蛋白质的是B.
(3)青霉素是最重要的抗生素.青霉素在人体内经酸性水解后,得到青霉素氨基酸,其结构简式如图所示:
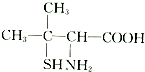
青霉素氨基酸中含有的官能团的名称为氨基、羧基.

 TiO2•XH2O↓+4HCl
TiO2•XH2O↓+4HCl 碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍.
碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍. 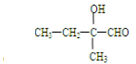 .
.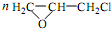 +CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$
+CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$ +nHCl
+nHCl