题目内容
有0.4g 铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75g 沉淀.这种铁的氧化物的化学式是( )A.FeO
B.Fe2O3
C.Fe3O4
D.FeO和Fe2O3
【答案】分析:根据原子守恒计算铁的氧化物中氧的物质的量,再计算出铁的物质的量,根据物质的量之比等于原子个数之比,从而确定氧化物的化学式.
解答:解:由题意知:0.75g 沉淀为CaCO3 ,根据碳原子守恒有n(CO2)=n(CaCO3 )= =0.0075mol
=0.0075mol
由于铁的氧化物,与足量的CO在高温下反应,生成的CO2,根据氧原子守恒有:
0.4g 铁的氧化物含氧原子的物质的量为:n(O)=n(CO2)=0.0075mol
所以,0.4g 铁的氧化物含铁原子的物质的量为:n(Fe)= =0.005mol
=0.005mol
所以,0.4g 铁的氧化物中铁原子的物质的量与氧原子的物质的量之比为: =
=
所以,该铁的氧化物的化学式为:Fe2O3
故选B.
点评:本题考查了复杂化学式的确定,利用原子守恒计算铁的氧化物中氧的物质的量是解本题的关键,再根据物质的量之比等于原子个数之比,从而确定氧化物的化学式.
解答:解:由题意知:0.75g 沉淀为CaCO3 ,根据碳原子守恒有n(CO2)=n(CaCO3 )=
 =0.0075mol
=0.0075mol由于铁的氧化物,与足量的CO在高温下反应,生成的CO2,根据氧原子守恒有:
0.4g 铁的氧化物含氧原子的物质的量为:n(O)=n(CO2)=0.0075mol
所以,0.4g 铁的氧化物含铁原子的物质的量为:n(Fe)=
 =0.005mol
=0.005mol所以,0.4g 铁的氧化物中铁原子的物质的量与氧原子的物质的量之比为:
 =
=
所以,该铁的氧化物的化学式为:Fe2O3
故选B.
点评:本题考查了复杂化学式的确定,利用原子守恒计算铁的氧化物中氧的物质的量是解本题的关键,再根据物质的量之比等于原子个数之比,从而确定氧化物的化学式.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
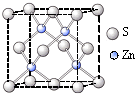
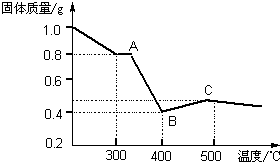 [定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为:
[定量研究]课题组在文献中查阅到,FeC2O4?2H2O受热分解时,固体质量随温度变化的曲线如图所示,写出加热到400℃时,FeC2O4?2H2O晶体受热分解的化学方程式为: