题目内容
【题目】废弃的锌猛干电池对环境污染很大,工业上可用如下工艺回收正极材料中的金属(部分条件未给出):
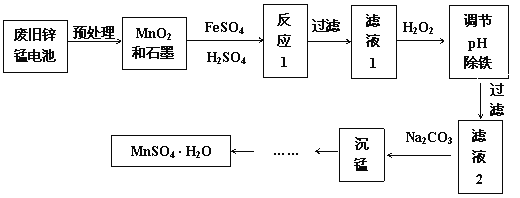
(1)MnO(OH)中Mn的化合价为__;实验室保存FeSO4溶液时为防止被氧化需加入__;实验室保存Fe2(SO4)3溶液时为抑制其水解应当加入__。
(2)加入H2O2的目的是将Fe2+氧化成Fe3+,则用离子方程式表示为___。
(3)该工艺流程中多次用到过滤,实验室中过滤所需要的玻璃仪器除烧杯外还有__。
(4)已知:25℃时,已知Ksp[Fe(OH)3]=1×10-38,当Fe3+浓度为1×10-5mol·L-1时,认为Fe3+沉淀完全,滤液1中加入NaOH溶液至pH=__时Fe3+沉淀完全。
【答案】+3 铁粉 硫酸 2Fe2++H2O2+2H+=2Fe3++2H2O 漏斗、玻璃棒 3
【解析】
(1)由化合价的代数和为0,可求出Mn的化合价;Fe2+被氧化时生成Fe3+,加入铁粉可将Fe3+还原为Fe2+;Fe2(SO4)3水解生成硫酸,溶液时为抑制其水解应当加入硫酸。
(2)加入H2O2的目的是将Fe2+氧化成Fe3+。
(3)实验室中过滤所需要的玻璃仪器除烧杯外,还需的仪器,可从过滤装置中寻找。
(4)Fe3+沉淀完全时,滤液1中c(OH-)可从Ksp[Fe(OH)3]=(Fe3+)×c3(OH-)=1×10-38求得,然后求其pH。
(1)MnO(OH)中,H为+1价,O为-2价,由化合价的代数和为0,可求出Mn的化合价为+3价;Fe2+被氧化时生成Fe3+,实验室保存FeSO4溶液时为防止被氧化需加入铁粉;Fe2(SO4)3水解生成硫酸,实验室保存Fe2(SO4)3溶液时为抑制其水解应当加入硫酸。答案为:+3;铁粉;硫酸;
(2)加入H2O2的目的是将Fe2+氧化成Fe3+,则H2O2被还原为H2O,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)实验室中过滤所需要的玻璃仪器除烧杯外,还需要的仪器为漏斗、玻璃棒。答案为:漏斗、玻璃棒;
(4)当Fe3+浓度为1×10-5mol·L-1时,认为Fe3+沉淀完全,则根据Ksp[Fe(OH)3]=(Fe3+)×c3(OH-)=1×10-38可知c(OH-)=10-11mol/L,c(H+)=10-3mol/L,pH=3。答案为:3。