题目内容
【题目】下面的排序不正确的是( )
A.晶体熔点的高低: >
> 
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
【答案】C
【解析】解:A.因为对位形成分子间氢键增大熔点,邻位形成分子内氢键降低熔点,所以晶体熔点的高低: ![]() >
>  ,故A正确; B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C﹣C<C﹣Si<Si﹣Si,所以硬度:金刚石>碳化硅>晶体硅,故B正确;
,故A正确; B、原子晶体中化学键键能越大、键长越短其硬度越大,这几种物质都是原子晶体,键长C﹣C<C﹣Si<Si﹣Si,所以硬度:金刚石>碳化硅>晶体硅,故B正确;
C、Na、Mg、Al原子半径依次减小,金属离子电荷逐渐增多,金属键逐渐增强,则熔点由高到低:Al>Mg>Na,故C错误;
D、晶格能与离子半径成反比,与电荷成正比,离子半径,F﹣<Cl﹣<Br﹣<I﹣ , 则晶格能NaF>NaCl>NaBr>NaI,故D正确;
故选C.
【考点精析】解答此题的关键在于理解晶体的类型与物质熔点、硬度、导电性等的关系的相关知识,掌握不同晶体类型的物质:原子晶体>离子晶体>分子晶体;同种晶体类型的物质:晶体内微粒间的作用力越大,溶、沸点越高.

【题目】某化学兴趣小组为探究浓硫酸的性质,设计了如下图所示的装置进行实验。
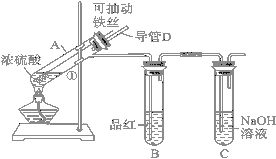
(1)用“可抽动的铁丝”代替“直接投入铁片”的优点是________________。
(2)说明SO2气体产生的实验现象是___________;装置C的作用是______________。
(3)反应一段时间后,他们对试管A中溶液的金属离子进行探究,请完成相关试题:
① 提出假设: 假设1:只含有Fe3+;
假设2:只含有Fe2+;
假设3:既有Fe2+,又有Fe3+。
② 请设计实验方案验证假设3。
限选试剂:稀硫酸、KMnO4溶液、KSCN溶液、NaOH溶液、H2O2溶液。
实验步骤 | 预期现象 |
步骤一:用胶头滴管取出A试管中的溶液,用水稀释后,并分装在试管Ⅰ、Ⅱ中备用 |
|
步骤二:检验Fe3+,往试管Ⅰ中,_____________ | _________________________ |
步骤三:检验Fe2+,往试管Ⅱ中,______________ | _________________________ |
(4)已知C+2H2SO4(浓)![]() 2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
2SO2↑+CO2↑+2H2O,该反应体现浓硫酸的_____
A.脱水性 B.强氧化性 C.吸水性
若要验证反应产物中同时混有SO2气体和CO2气体,可选择以下试剂进行实验:
NaOH溶液 ②品红溶液 ③溴水 ④Ca(OH)2溶液
选择合适试剂,并安排合理的顺序为_____________________(填序号)。

