题目内容
下列叙述正确的是
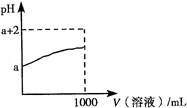
- A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
- B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
- C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH值不变
- D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
C
试题分析:盐酸中加氨水,若恰好完全反应,溶液呈酸性,要使溶液呈中性,需再加氨水,所以溶质为氯化铵和一水合氨,A错误;醋酸加水稀释,醋酸电离程度增大,c(H+)、c(CH3COO-)减小,pH增大,B错误;饱和石灰水中加生石灰恢复到室温时仍是饱和石灰水,pH不变,C正确;沸水中滴加饱和氯化铁溶液形成氢氧化铁胶体,氢氧化铁胶粒带正电荷,D错误。
考点:盐类水解 弱电解质电离平衡 胶体
点评:酸碱完全中和与pH=7意义不同。
试题分析:盐酸中加氨水,若恰好完全反应,溶液呈酸性,要使溶液呈中性,需再加氨水,所以溶质为氯化铵和一水合氨,A错误;醋酸加水稀释,醋酸电离程度增大,c(H+)、c(CH3COO-)减小,pH增大,B错误;饱和石灰水中加生石灰恢复到室温时仍是饱和石灰水,pH不变,C正确;沸水中滴加饱和氯化铁溶液形成氢氧化铁胶体,氢氧化铁胶粒带正电荷,D错误。
考点:盐类水解 弱电解质电离平衡 胶体
点评:酸碱完全中和与pH=7意义不同。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
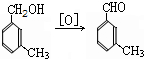
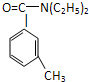 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH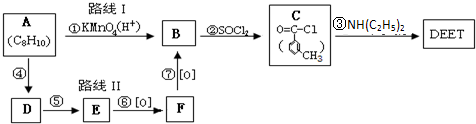
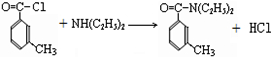
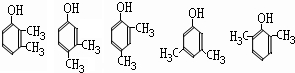 (任写2种)
(任写2种)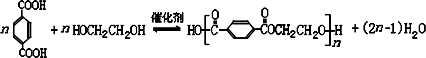
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.