题目内容
常温下干燥的混合气体可能由H2S、H2、Cl2、SO2、NH3、NO2、NO、CO2和O2中的某几种组成.现进行如下实验:
①混合气体无色,其密度比空气密度大;
②混合气体不能使湿润的品红试纸褪色,打开瓶塞无颜色变化;
③混合气体通过浓硫酸时出现混浊,但气体的体积变化不明显,再通过碱石灰,气体体积缩小到原来的10%;
④上述通过碱石灰的混合气体,若点燃会爆炸,恢复到常温时,剩余气体体积为通过浓硫酸和碱石灰之前的原混合气体的2.5%,若使其通过赤热的铜网,铜网表面变黑.
⑤当原混合气体通过硫酸铜溶液时,剩余气体为原来的90%.
根据以上实验,回答下列问题:
(1)原混合物气体中一定含有________,一定不含有________.
(2)原混合气体的平均摩尔质量为________.
解析:
(1)H2S、H2、CO2、O2 Cl2、SO2、NH3、NO2、NO.
(2)40.3 g/mol.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案X、Y、Z、W均为含有10电子的微粒,W为金属阳离子,X、Y、Z常温下为气体,
(1)已知: W + X + H2O → 白色沉淀。
①若实验室用下图所示装置、干燥和收集装置制取并收集干燥的X,A中分液漏斗中的液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
②由W离子形成的可溶性盐WCln,其水溶液显_________性,原因是(用离子方程式表示)_____________________________________________________
③为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,_____________________________________________________
(2)常温下,取10 mLpH= a的Y的稀溶液,加水稀释时pH随溶液体积V的变化如图所示,则①Y的化学式为__________。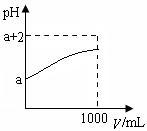
②下列有关Y的叙述正确的是__________
| A.Y溶于水后部分发生电离 |
| B.Y的水溶液中滴加石蕊试液会变红 |
| C.稀释后溶液中所有离子的浓度均减小 |
| D.稀释后,阴离子的物质的量浓度之和不变 |
(用实际离子符号表示)
(3)已知H2的燃烧热为285.8 kJ·mol-1。现有Z和H2的混合气体共0.2 mol,与O2完全燃烧生成H2O(l)和CO2(g),转移电子的物质的量为1.0 mol,放出的热量为117.6 kJ。写出Z完全燃烧的热化学反应方程式__________________________________