题目内容
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用.其工作流程如下:
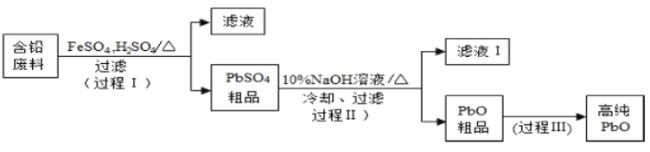
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_______________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++![]() ═2Fe3++PbSO4+2H2O
═2Fe3++PbSO4+2H2O
ii:…
①写出ii的离子方程式:_______________。
②下列实验方案可证实上述催化过程,将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红;
b._______________。
(3)过程Ⅱ的目的是脱硫.滤液Ⅰ经处理后可在过程Ⅱ中重复使用,其目的是_______________(选填序号)。
A.减小Pb的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
【答案】Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O 2Fe3++Pb+
2PbSO4+2H2O 2Fe3++Pb+![]() ═PbSO4+2Fe2+ 取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去 AB
═PbSO4+2Fe2+ 取a中红色溶液少量,加入过量Pb,充分反应后,红色褪去 AB
【解析】
根据工艺流程分析可知,过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4和水,过滤后得到PbSO4的粗品,向粗品中加入10%的NaOH溶液,发生反应PSO4+2NaOH=PbO+Na2SO4+H2O,冷却过滤后得到PbO的粗品,经过程Ⅲ得到高纯度的PbO,据此分析解答问题。
(1)结合工艺流程图,过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4和水,化学方程式为:Pb+PbO2+2H2SO4=Fe2+=![]() 2PbSO4+2H2O;
2PbSO4+2H2O;
(2)①催化剂参加反应,改变反应历程,降低反应活化能,加快反应速率,而本身的质量和化学性质在反应前后保持不变,i中Fe2+被氧化为Fe3+,ii中Fe3+被还原成Fe2+,离子方程式:2Fe3++Pb+![]() ═PbSO4+2Fe2+;
═PbSO4+2Fe2+;
②取a中红色溶液少量,溶液中存在平衡,Fe3++SCN―=Fe(SCN)3加入过量Pb,Fe3+ 被还原成Fe2+,平衡逆向移动,充分反应后,红色褪去;
(3)过程Ⅱ脱硫过程中发生的反应为PSO4+2NaOH=PbO+Na2SO4+H2O,由于PbO能溶解于NaOH溶液,因此滤液I中含有Pb元素,重复使用滤液I可减少PbO的损失,且滤液I中过量的NaOH可以重新利用,提高原料的利用率,故选AB。