题目内容
在10mL pH=12的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
| A.0.01mol/L CH3COOH | B.0.01mol/L HNO3 |
| C.pH=2的H2SO4溶液 | D.pH=2的CH3COOH溶液 |
D
解析试题分析:加入10mL pH=2的硫酸,恰好反应生成硫酸钠,溶液呈中性,故C错误;加入0.01 mol?L﹣1的 CH3COOH,生成乙酸钠,为强碱弱酸盐,水解呈碱性,故A错误;pH=2的醋酸浓度比pH=12的NaOH溶液大,反应后醋酸过量,溶液呈酸性,故D正确;加入0.01 mol?L﹣1的硝酸,恰好反应生成硝酸钠,溶液呈中性,故B错误。故选:D。
考点:本题考查酸碱混合的定性判断和计算。

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
常温下,往c1mo1/L的醋酸溶液中滴加同体积的c2 mo1/L的氢氧化钠溶液后,所得溶液的pH=7,则
| A.酸碱恰好中和 | B.c1=c2 |
| C.滴人酚酞溶液呈浅红色 | D.所得溶液c(Na+)=c(CH3COO一) |
在H2O+CH3COO- CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
| A.加入NaOH固体 | B.加入冰醋酸 | C.增大压强 | D.升高温度 |
对pH值相同的盐酸和醋酸两种溶液的说法正确的是
| A.中和碱的能力相同 | B.盐酸和醋酸的物质的量浓度相同 |
| C.OH-的物质的量浓度相同 | D.H+的物质的量浓度不同 |
下列事实中不能证明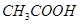 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D.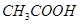 属于共价化合物 属于共价化合物 |
25℃,向一定体积0.1mol/L的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中c(H+)与c(OH—)的变化关系如图所示,则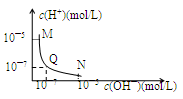
| A.M点所示溶液的导电能力强于Q点 |
| B.N点所示溶液中c(CH3COO―)>c(Na+) |
| C.Q点消耗NaOH溶液的体积等于醋酸溶液的体积 |
| D.M点和N点所示溶液中H2O的电离程度相同 |
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
| A.1.7 | B.2.0 | C.12.0 | D.12.4 |
下列说法不正确的是
| A.Ksp只与难溶电解质的性质和温度有关 |
| B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 |
| C.其他条件不变,离子浓度改变时,Ksp不变 |
| D.两种难溶电解质作比较时,Ksp小的,溶解度一定小 |
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是 ( )。
| A.W点所示的溶液中:c(Na+)+c(H+)=2c(CO32—)+c(OH-)+c(Cl-) |
| B.pH=4的溶液中:c(H2CO3)+c(HCO3—)+c(CO32—)<0.1 mol·L-1 |
| C.pH=8的溶液中:c(H+)+c(H2CO3)+c(HCO3—)=c(OH-)+c(Cl-) |
| D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32—)>c(HCO3—)>c(H2CO3) |