题目内容
14.下列物质的熔沸点比较错误的是( )| A. | NH3>PH3 | B. | CO2>SiO2 | C. | SiCl4>CCl4 | D. | MgO>KCl |
分析 A.氢化物中含有氢键的物质熔沸点较高;
B.原子晶体熔沸点高于分子晶体;
C.分子晶体熔沸点与其相对分子质量成正比;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比.
解答 解:A.氢化物中含有氢键的物质熔沸点较高,氨气中含有氢键、膦中不含氢键,所以熔沸点NH3>PH3,故A正确;
B.原子晶体熔沸点高于分子晶体,二氧化碳是分子晶体、二氧化硅是原子晶体,所以熔沸点CO2<SiO2,故B错误;
C.分子晶体熔沸点与其相对分子质量成正比,相对分子质量SiCl4>CCl4,所以熔沸点SiCl4>CCl4,故C正确;
D.离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,MgO和KCl都是离子晶体,镁离子电荷大于钾离子、氧离子电荷大于氯离子,镁离子和氧离子半径都小于钾离子和氯离子,所以氧化镁晶格能大于KCl,则熔沸点MgO>KCl,故D正确.
故选B.
点评 本题考查晶体熔沸点高低判断,明确熔沸点与晶体类型、氢键、晶格能、相对分子质量的关系即可解答,注意氢键只影响物理性质不影响化学性质,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
4.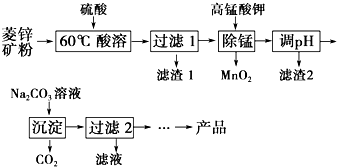 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
(1)ZnCO3酸溶时的离子方程式为ZnCO3+2H+═Zn2++H2O+CO2↑.
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
(2)用KMnO4溶液除去Mn2+的离子方程式为2MnO4-+3Mn2++2H2O═5MnO2↓+4H+.
(3)滤渣2主要成分的化学式是Fe(OH)3.
(4)过滤2所得滤液中含有的主要阳离子是Na+、K+.
(5)生成的产品需经充分洗涤,检验产品完全洗净的方法是取最后一次洗涤液,加盐酸酸化的氯化钡溶液,若无沉淀,则已洗净.
(6)Zn2+完全沉淀时溶液中c(Zn2+)=10-5mol•L-1,则该温度下Ksp[Zn(OH)2]的值为10-17.
9.欲除去下列物质中混入的少量杂质(括号内物质为杂质),不能达到目的是( )
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
19.下列说法正确的是( )
| A. | 分子间作用力与化学键的键能大小相当 | |
| B. | 分子间作用力远强于化学键,是一种很强的作用 | |
| C. | 氢键主要影响物质的化学性质 | |
| D. | 分子内部的相邻原子之间强烈的相互作用称为化学键,而分子之间存在的相互作用称为分子间作用力 |
6.X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为互为同位素;R在元素周期表中的位置是第3周期ⅦA族.
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
| X | Y | Z | M | R | Q | |
| 原子半 径/nm | 0.154 | 0.074 | 0.099 | 0.143 | ||
| 主要 化合价 | -4, +4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核 外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(2)Z的单质与水反应的化学方程式是2Na+2H2O═2NaOH+H2↑;R与Q两元素最高价氧化物水化物反应的离子方程式3H++Al(OH)3═Al3++3H2O.
(3)Y与R相比,非金属性较强的是Cl(用元素符号表示),下列事实能证明这一结论的是b、c(填字母序号).
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径的最小范围是0.099nm-0.144nm;写出工业制取Y的单质的化学方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
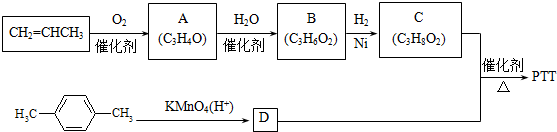
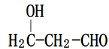 .
.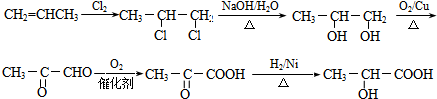 .
.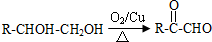

 ; F
; F  ;
;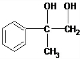 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O;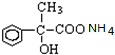 +2Ag↓+3NH3+H2O.
+2Ag↓+3NH3+H2O. 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: