题目内容
已知常温下CH3COOH的电离平衡常数为Ka ,常温下,向20mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/LNaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
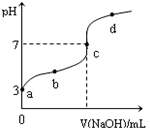
[ ]
A. a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol/L
B. b点表示的溶液c(CH3COO-)< c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. b、d点表示的溶液中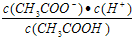 相等
相等
B. b点表示的溶液c(CH3COO-)< c(Na+)
C. c点表示CH3COOH和NaOH恰好反应完全
D. b、d点表示的溶液中
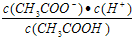 相等
相等 D

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
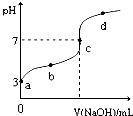 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol?L-1 | ||
| B、b点表示的溶液c(CH3COO-)<c(Na+) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、b、d点表示的溶液中
|
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是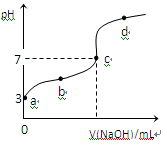
| A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1 |
| B.b点表示的溶液c(CH3COO-) > c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中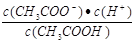 相等 相等 |
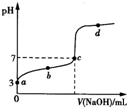 已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知常温下CH3COOH的电离平衡常数为K.该温度下向20mL 0.1 mol?L-1 CH3COOH溶液中逐滴加入0.1 mol?L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )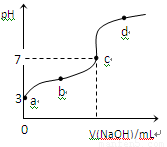
 相等
相等