题目内容
在某容积为2.0L的密闭容器中充入5.0g N2O4气体,其中发生的反应:
N2O4(g) 2NO2(g)在1.01×105Pa、45℃下建立化学平衡,此时1mol混合气体占有体积为26.1L,求上述平衡混合气体中NO2的质量分数.
2NO2(g)在1.01×105Pa、45℃下建立化学平衡,此时1mol混合气体占有体积为26.1L,求上述平衡混合气体中NO2的质量分数.
答案:
解析:
解析:
|
解:N2O4 1mol 2mol 起始时有N2O4气体5.0g÷92g/mol=(5.0/92)mol 平衡时共有气体2.0L÷26.1L/mol=(2.0/26.1)mol 可见平衡时有NO2[(2.0/26.1)mol-(5.0/92)mol]×2×46g/mol=2.0g 平衡混合物中NO2的质量分数为2.0g+5.0g×100%=40% |

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
 2NO2
2NO2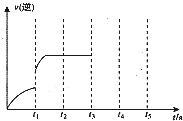 (2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
(2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
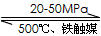 2NH3(g) △H=-192.0kJ·mol-1
2NH3(g) △H=-192.0kJ·mol-1 
 NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式:_____________________。