题目内容
14.最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据.下列说法正确的是( )| A. | 18O是氧元素的一种核素,它的中子数是8 | |
| B. | O4和O2是互为同位素 | |
| C. | 同温同压下,等体积的O4气体和O2含有相同的分子数 | |
| D. | O4转化O2为物理性质 |
分析 A.根据原子符号中,左下角数字表示质子数,左上角数字为质量数,中子数=质量数-质子数分析;
B.有相同质子数,不同中子数的原子互为同位素,相同元素组成,不同形态的单质互为同素异形体;
C.同温同压下,Vm相同,同温同压下,相同体积的任何气体含有相同分子数;
D.物理变化与化学变化的本质区别是否有新物质的生成;
解答 解:A.18O的质子数是8,质量数是18,中子数=质量数-质子数=18-8=10,故A错误;
B.O4和O2都是由氧元素形成的不同单质,故互为同素异形体,故B错误;
C.O4和O2都是气体,同温同压条件下,Vm相同,则相同体积的任何气体具有相同的分子数,故C正确;
D.O4和O2不是同种物质,所以O4转化O2为化学变化,故D错误;
故选C.
点评 本题考查了核素的表示方法、同位素、阿伏伽德罗定律、化学变化和物理变化区别,属于对基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.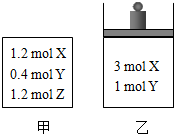 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
 在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )
在温度、初始容积相同的两个密闭容器中,按不同方式投入反应物(如图所示),发生如下反应:3X(g)+Y(g)?2Z(g)△H<0,保持温度不变,测得平衡时的有关数据如下:下列说法正确的是( )| 恒容容器甲 | 恒压容器乙 | |
| Y的物质的量/mol | n1 | n2 |
| Z的体积分数 | φ1 | φ2 |
| A. | 平衡时容器乙的容积一定比反应前大 | |
| B. | 平衡时容器甲的压强一定比反应前大 | |
| C. | n2>n1 | |
| D. | φ2>φ1 |
5.X、Y、Z、W四种元素在元素周期表中的相对位置如下图所示,其中X、W的质子数之和为21,由此可知( )
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第VA族 | |
| B. | Y的氢化物(H2Y)不稳定,100℃以上即可分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物是一种强碱 |
9. 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 | |
| B. | 由于键能H-R>H-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 最高价氧化物对应的水化物的酸性:X<T<Q |
3.如图是一个氢核磁共振谱,请你观察图谱,分析其可能是下列物质中( )


| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2OH | C. | 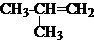 | D. | 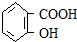 |
4.新闻:美国《科学》杂志12月17日评选出2004十大科学突破中,有多项与水有关,其中之一是关于对水的研究有新进展,一些科学家对于水分子如何聚合以及电子及质子如何在水中溶解等问题上,都有了新发现.另据 2004年4月14日中科院网报道,中科院物理所王恩哥小组他们首次证明存在一种稳定的二维冰相.它是由四角形和八角形的氢键网格交替组成的,研究人员把这种新的冰结构命名为镶嵌冰.有趣的是,这种镶嵌冰可以在室温下稳定存在.有关这种镶嵌冰的推测肯定不正确的( )
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
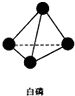 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA