题目内容
19. 前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
前四周期原子序数依次增大的六种元素A,B,D,X,Y,Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:(1)Z2+的价层电子排布式为3d8.
(2)D,X,Y三种元素中第一电离能从大到小的顺序是F>Fe>K.(填元素符号)
(3)分子式为AD的化合物常以多聚体(AD)n的形式存在,请解释原因HF分子间能形成氢键.
(4)B和氮原子可形成化合物(BN)2,(BN)2分子中中心原子的杂化方式为sp,φ键和π键的个数之比为3:4,空间构型为直线形.
(5)D-、X+、Y3+三种离子组成的化合物X3YD6,其中化学键的类型有离子键和配位键;该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-.
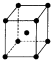
(6)Y晶体的晶胞如图所示,晶胞边长为apm,则Y的配位数为8,晶体的密度为$\frac{1.12×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3.(用NA 表示阿伏伽德罗常数的值)
分析 D和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8,而原子序数D>X,则D比X多两个电子层,由于都是前四周期元素,D至少位于第二周期,则X只能为第四周期元素,结合二者离子中所带电荷可知,D为F元素、X为K元素;A和B位于不同周期,B的原子序数小于D,则B位于第二周期、A处于第一周期,A的电子层数和最外层电子数相等,则A为H元素;非金属元素B的已成对电子数是未成对电子数的2倍,且处于第二周期,则B的电子排布式为:1s22s23p2,为C元素;Y、Z与X位于同一周期,说明Y和Z处于第四周期,二者的价电子层中的未成对电子数分别为4和2,且原子序数相差为2,则Y、Z的基态原子核外电子排布式分别为:1s22s22p63s23p63d64s2、1s22s22p63s23p63d84s2,即Y为Fe、Z为Ni,据此进行解答.
解答 解:和X的价电子层中未成对电子均只有1个,并且D-和X+的电子相差为8,而原子序数D>X,则D比X多两个电子层,由于都是前四周期元素,D至少位于第二周期,则X只能为第四周期元素,结合二者离子中所带电荷可知,D为F元素、X为K元素;A和B位于不同周期,B的原子序数小于D,则B位于第二周期、A处于第一周期,A的电子层数和最外层电子数相等,则A为H元素;非金属元素B的已成对电子数是未成对电子数的2倍,且处于第二周期,则B的电子排布式为:1s22s23p2,为C元素;Y、Z与X位于同一周期,说明Y和Z处于第四周期,二者的价电子层中的未成对电子数分别为4和2,且原子序数相差为2,则Y、Z的基态原子核外电子排布式分别为:1s22s22p63s23p63d64s2、1s22s22p63s23p63d84s2,即Y为Fe、Z为Ni,
(1)Z为Ni元素,Z2+的核外电子排布式为:1s22s22p63s23p63d8,则其价层电子排布式为:3d8,
故答案为:3d8;
(2)D,X,Y三种元素分别为F、K、Fe,金属性越强,第一电离能越小,非金属性越强,第一电离能越大,则三种元素中第一电离能从大到小的顺序是:F>Fe>K,
故答案为:F>Fe>K;
(3)A、D分别为H、F元素,F元素非极性较强,HF分子间能形成氢键,所以分子式为HF的化合物常以多聚体(HF)n的形式存在,
故答案为:HF分子间能形成氢键;
(4)B为C元素,C和氮原子可形成化合物(CN)2,(CN)2分子中存在C≡N键,其结构式为:N≡C-C≡N,每个三键中含有2个π键和1个σ键,所以中心原子C原子的杂化方式为sp;(CN)2分子中含有3个σ键、4个π键,所以σ键和π键的数目之比为:3:4;其空间构型为直线形,
故答案为:sp;3:4;直线形;
(5)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-,
故答案为:离子键和配位键;[FeF6]3-;F-;
(6)Y为Fe元素,Fe位于晶胞体心,距离Fe最近的Fe原子位于晶胞顶点,共有8个,即Fe的配位数为8;该晶胞的边长为apm,则晶胞体积为(a×10-10cm)3,每个晶胞中含有Fe原子数为:8×$\frac{1}{8}$+1=2,则晶胞的质量为:$\frac{56}{{N}_{A}}$×2g=$\frac{112}{{N}_{A}}$g,所以晶胞的密度为:$\frac{\frac{112g}{{N}_{A}}}{(a×1{0}^{-10}cm)^{3}}$=$\frac{1.12×1{0}^{32}}{{a}^{3}{N}_{A}}$g/cm3,
故答案为:8;$\frac{1.12×1{0}^{32}}{{a}^{3}{N}_{A}}$.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度较大,涉及晶胞计算、化学键类型判断、核外电子排布、第一电离能等知识,正确推断各元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.

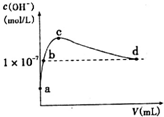 常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )
常温下,向l L pH=l0的NaOH溶液中持续通入CO2.通入CO2的体积(y)与溶液中水电离出的c(OH-)的关系如图所示.下列叙述错误的是( )| A. | a点溶液中:水电离出的c(H+)=1×10-10mol•L-1 | |
| B. | b点溶液中:c(H+)=1×10-7mol•L-1 | |
| C. | c点溶液中:c(Na+)>c(HCO3-)>c(CO32-) | |
| D. | d点溶液中:c(Na+)=2c(CO32-)+c(HCO3-) |
| A. | B的单质不存在同素异形体 | |
| B. | 单质D着火时,可用二氧化碳灭火器灭火 | |
| C. | 化合物A2B2与C2B2均只有氧化性 | |
| D. | A、B、C组成的化合物,25℃时若溶液浓度为0.1mol/L,则由水电离出的OH-为10-13mol/L |
| A. | 2NA个H2O | B. | 常温常压下,48g O2 | ||
| C. | 标准状况下,22.4L H2 | D. | 0.5mol CO2 |
| A. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算. | |
| B. | 蒸馏时可用多种方法控制温度,用水浴加热分离碘并回收苯时,实验结束后,碘留在蒸馏烧瓶中. | |
| C. | 金属钾、钠和白磷等暴露在空气中易燃烧,所以金属钾、钠保存在煤油中,白磷则可保存在水中. | |
| D. | 工业上电解饱和和盐水时,从安全性和综合效率角度考虑,往往用阴离子交换膜把阳极和阴极隔开 |
| A. | 14gC2H4和C4H8NA的混合气体中所含的共价键数为3NA | |
| B. | 化学反应中每生成1molO2转移电子数为4NA | |
| C. | 12g413C含有的碳原子数是NA | |
| D. | 0.1molNa2O2所含阴离子数是0.2NA |
 某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案.
 ,该反应的类型为酯化反应;
,该反应的类型为酯化反应;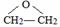 ;
;
 NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.
NaClO+H2↑.电解结束后一段时间,有同学发现铁电极表面变成红褐色,则反应方程式为3NaClO+2Fe+3H2O=2Fe(OH)3↓+3NaCl.