题目内容
17.设NA代表阿伏伽德罗常数的值,下列说法正确的是( )| A. | 28g CO和16g O2所含的原子数都为2NA | |
| B. | 300mL 2mol/L乙醇水溶液中所含H原子数为3.6NA | |
| C. | 标准状况下,22.4L CO2和O2的混合气体含有的分子总数为NA | |
| D. | 5.6g Fe与足量Cl2反应时转移电子总数为0.2NA |
分析 A、分别求出两者的物质的量n=$\frac{m}{M}$,然后根据CO和氧气均为双原子分子构成来分析;
B、乙醇溶液中,除了乙醇,水也含有氢原子;
C、根据分子数N=$\frac{V}{{V}_{m}}{N}_{A}$来计算;
D、求出铁的物质的量,然后根据铁反应后变为+3价来分析.
解答 解:A、28gCO的物质的量n=$\frac{m}{M}$=$\frac{28g}{28g/mol}$=1mol,含2mol原子即2NA个;16g氧气的物质的量为0.5mol,故含1mol氧原子即NA个,故A错误;
B、乙醇溶液中,除了乙醇,水也含有氢原子,故含有的氢原子个数大于3.6NA个,故B错误;
C、标况下,22.4L混合气体中的分子数N=$\frac{V}{{V}_{m}}{N}_{A}$=$\frac{22.4L}{22.4L/mol}{N}_{A}$=NA个,故C正确;
D、5.6g铁的物质的量为0.1mol,而铁反应后变为+3价,故0.1mol铁失去0.3mol电子即0.3NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,应注意物质的组成和反应后元素的价态,难度不大.

练习册系列答案
相关题目
8.下列粒子结构示意图中,表示阳离子的是( )
| A. |  | B. |  | C. |  | D. |  |
12.某温度下,在容积不变的密闭容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol和4mol,保持温度和容积不变,对平衡混合物中三者的物质的量做如下调整,A的转化率降低的是( )
| A. | 均加倍 | B. | 加入1mol C | C. | 均增加1mol | D. | 均减半 |
3.环己酮是如图1种重要的化工原料、有机溶剂.
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
制备粗产品:
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.
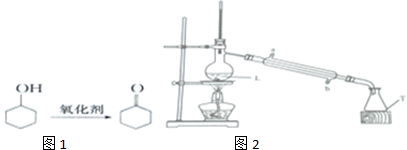
提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%
设计下列实验制备环己酮:
实验原理利用环己醇可在重铬酸钾溶液中氧化制得(副产物省略):
副产物可能有己二酸(HOOCCH2CH2CH2CH2COOH)等.可能用到的有关数据如下:
| 相对分子量 | 密度/g•cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 26 | 161 | 微溶于水 |
| 环己酮 | 0.8102 | 0.8102 | -45 | 155.6 | 微溶于水 |
准确称取10.0g环己醇装于一只大烧杯里,分三次加入6g重铬酸钾和3mL浓硫酸,每加一次都要振摇混匀,并控制反应温度在55~60℃.反应约30min后温度开始下降,再放置15min,其间不断振荡,使反应液呈墨绿色为止.

提纯产品:
步骤1:向反应液中加入适量蒸馏水,按下列装置如2行水蒸气蒸馏.
步骤2:收集所有馏出液,向馏出液中加入饱和食盐水,分液得到有机物.
步骤3:用乙醚萃取水溶液中有机物,将萃取液合并于有机化合物中.
步骤4:将有机混合物再装于下列装置L中,加入适量生石灰,再蒸馏,收集151~155℃馏分,得到产品6.5g.
请回答下列问题:
(1)重铬酸钾是强氧化剂,分批加入的目的是减少副产物生成.制备产品温度控制在55~60℃,应选择的加热方式是水浴加热(填“直接加热”或“水浴加热”).
(2)在提纯产品的步骤3中用乙醚萃取水溶液中有机物,其目的是减少产品损失.
(3)在分馏中,如果用烧杯替代T仪器,产率可能会偏低( 填“偏高”“偏低”或“无影响”,下同),如果用氯化钙替代生石灰,产率可能会偏高,如果温度计水银球高于支管口,产率可能会偏高.
(4)在实验过程中,是先B后A(填“A”或“B”,A为加热酒精灯,B为通冷凝水),冷凝管中进水口是b(填“a”或“b”),加热之前,应在L烧瓶中加入几块碎瓷片,其目的是防液体暴沸.
(5)设计一个简单实验证明含少量环己醇杂质的产品中是否有己二酸:取产品于试管,加入蒸馏水,再加入碳酸氢钠溶液,弱产生气泡,则含有己二酸.否则,不含己二酸(写出步骤、现象和结论).
(6)根据上述数据,计算本实验产率为B.
A.65.0% B.66.3% C.68.6% D.70.2%
10.下列实验方法一定错误的是( )
| A. | 人们直接用肉眼观察物质的颜色、状态 | |
| B. | 闻药品的气味 | |
| C. | 品尝物质的味道 | |
| D. | 借助仪器进行观察 |
8.下列物质中既存在离子键又存在共价键的是( )
| A. | K2S | B. | NaOH | C. | SiO2 | D. | CO2 |

