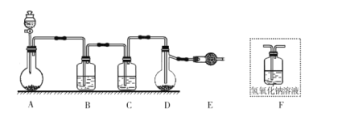
题目内容
【题目】如图是硫酸试剂标签上的部分内容。请回答下列问题:

(1)该浓硫酸中溶质、溶剂分子数目之比为___,现用该浓H2SO4来配制480mL、0.3mol·L-1的稀H2SO4,需量取该浓H2SO4的体积为___mL。
(2)配制时,下列仪器中必须使用___(填代号),还缺少的仪器是___、___。
①托盘天平(带砝码) ②10mL量筒 ③20mL量筒 ④烧杯 ⑤玻璃棒 ⑥100mL容量瓶 ⑦漏斗 ⑧烧瓶
(3)在配制过程中,下列操作中能使所配溶液的浓度偏高的有___(填代号)。
①用量筒量取98%的硫酸时俯视
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,仰视刻度线
【答案】9:1 8.2 ②④⑤ 500mL容量瓶 胶头滴管 ②③
【解析】
(1)该浓硫酸的质量分数为98%,100g溶液中,溶质是98g,溶剂为2g,利用公式![]() 计算溶质和溶剂的分子数目之比;用该浓H2SO4来配制480mL、0.3 mol·L-1的稀H2SO4,由于没有480mL的容量瓶,所以应选择500mL的容量瓶,再根据稀释定律,稀释前后溶质物质的量不变,进行计算;
计算溶质和溶剂的分子数目之比;用该浓H2SO4来配制480mL、0.3 mol·L-1的稀H2SO4,由于没有480mL的容量瓶,所以应选择500mL的容量瓶,再根据稀释定律,稀释前后溶质物质的量不变,进行计算;
(2)配制时,量取浓硫酸8.2mL,用10mL的量筒;根据配制一定物质的量浓度的溶液的步骤,判断需要的仪器;
(3)根据![]() ,分析配制过程中溶质物质的量或溶液体积的变化,进而判断误差。
,分析配制过程中溶质物质的量或溶液体积的变化,进而判断误差。
(1)该浓硫酸的质量分数为98%,100g溶液中,溶质是98g,溶剂为2g,所以溶质和溶剂的分子数目之比= ;用该浓H2SO4来配制480mL、0.3 mol·L-1的稀H2SO4,由于没有480mL的容量瓶,所以应选择500mL的容量瓶,设需要浓硫酸的体积为x mL,根据稀释前后溶质物质的量不变,得1.84g/cm3×x mL×98%=0.5L×0.3mol/L×98g/mol,解得x=8.2;
;用该浓H2SO4来配制480mL、0.3 mol·L-1的稀H2SO4,由于没有480mL的容量瓶,所以应选择500mL的容量瓶,设需要浓硫酸的体积为x mL,根据稀释前后溶质物质的量不变,得1.84g/cm3×x mL×98%=0.5L×0.3mol/L×98g/mol,解得x=8.2;
故答案为:9:1;8.2;
(2)配制时,量取浓硫酸8.2mL,用10mL的量筒;根据配制一定物质的量浓度的溶液的步骤:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,判断还需要的仪器为500mL容量瓶、胶头滴管;
故答案为:②④⑤;500mL容量瓶;胶头滴管;
(3)①用量筒量取98%的浓硫酸时俯视,导致量取硫酸的量偏小,浓度偏低,故①不符;
②洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中,会导致硫酸的量增加,浓度偏高,故②符合;
③未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,由于热胀冷缩,到达刻度线实际加水量偏少,浓度偏高,故③符合;
④转移前,容量瓶中含有少量蒸馏水对结果无影响,故④不符;
⑤定容时,加蒸馏水超过标线,又用胶头滴管吸出,导致硫酸的量偏小,使浓度偏小,故⑤不符;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,加水量偏多,浓度偏小,故⑥不符;
⑦定容时,仰视刻度线,使加水量偏多,浓度偏小,故⑦不符;
综上所述,②③操作能使所配溶液的浓度偏高;
故答案为:②③。

【题目】中科院一项新研究成果实现了甲烷高效生产乙烯,其反应为:2CH4(g)![]() C2H4(g)+2H2(g) ΔH>0
C2H4(g)+2H2(g) ΔH>0
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如表,完成热化学方程式:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=__。
C2H4(g)+2H2(g) ΔH=__。
(2)温度为T1℃时,向1 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应0~15 min CH4的物质的量随时间变化如图1,实验测得10~15 min时H2的浓度为1.6 mol/L。

①若图1中曲线a、b分别表示在T1℃时,使用等质量的两种不同的催化剂时,达到平衡过程中n(CH4)变化曲线,判断:催化剂a_____b(填“优于”或“劣于”)。
②在15 min时改变反应条件,导致n(CH4)发生变化(见图1),则改变的条件可能是:_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数仅与温度有关,温度为![]() 时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
(4)科研人员设计了甲烷燃料电池并用于电解(如图2)。电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
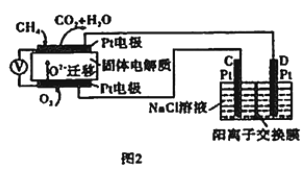
①图中C处的Pt为_______(填“阴”或“阳”)极。
②该电池工作时负极的电极反应式为________。
③用该电池电解饱和食盐水,一段时间后收集到标准状况下气体总体积为112 mL,则阴极区所得溶液在25℃时pH=_______(假设电解前后NaCl溶液的体积均为500 mL)。