题目内容
已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
请回答下列问题:
(1)X的化学式为 。
(2)在反应①②③④中属于置换反应的是 (填序号)。
(3)反应③的化学方程式为_________________________________。
(4)X溶液与F反应的总化学方程式为 。
(5)检验滤液A中金属离子的方法是 。
(6)若向100 mL盐X的溶液中加入10 g过量金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体。则滤液A中溶质的物质的量浓度为_________。(假设溶液体积不变)
(1)Cu(NO3)2 (2)①③
(3)Fe2O3 + 2Al  Al2O3 + 2Fe
Al2O3 + 2Fe
(4)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑
(5)取少量滤液A加入NaOH溶液,产生白色沉淀,沉淀变成灰绿色最后变成红褐色
(6)0.2 mol/L
解析试题分析:F为淡黄色固体,应为Na2O2,蓝色沉淀Y为Cu(OH)2,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承,应为Al2O3,则N为Al,过氧化钠与水反应生成的H为O2,D为无色气体,在空气中会出现红棕色,则D为NO,说明X为Cu(NO3)2,由A→D生物反应可知A中含有Fe2+,则M为Fe,C为Cu,G应为Fe(OH)3,E为Fe2O3,(1)由以上分析可知X为Cu(NO3)2,故答案为:Cu(NO3)2;(2)根据题中反应转化关系可知,反应①③都有单质参加和生成,为置换反应,②④没有单质生成,肯定不是置换反应,故答案为:①③;(3)反应③是铝热反应,化学方程式为Fe2O3 + 2Al  Al2O3 + 2Fe 。(4)Cu(NO3)2溶液与Na2O2反应的总化学方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑,故答案为:2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑;(5)反应为Fe+Cu2+=Cu+Fe2+,n(Fe)=10/56=0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4mol,但得10.16g固体,说明Fe过量,则可用差量法计算,
Al2O3 + 2Fe 。(4)Cu(NO3)2溶液与Na2O2反应的总化学方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑,故答案为:2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑;(5)反应为Fe+Cu2+=Cu+Fe2+,n(Fe)=10/56=0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4mol,但得10.16g固体,说明Fe过量,则可用差量法计算,
Fe+Cu2+=Cu+Fe2+ △m
1mol 8g
n 0.16g
n=0.02mol,c=0.02/0.1=0.2mol/L,故答案为:0.2 mol/L。
考点:本题考查了无机物的推断,题目难度中等,解答本题注意根据物质的颜色、用途作为突破口进行推断,注意混合物的计算方法的把握。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
|
|

 (1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
已知下列转化关系中M、N均为单质,则M可能是
| A.Na | B.Fe | C.O2 | D.H2 |
今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化: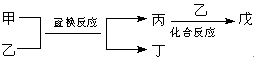
其推断正确的是
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| A | NH3 | O2 | NO | H2O | NO2 |
| B | Mg | CO2 | C | MgO | CO |
| C | C | H2O | CO | H2 | HCOOH |
| D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )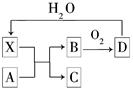
| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可看到白色沉淀 |
| D.工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
下表各组物质中,满足如图物质一步转化关系的选项是( )
| 选项 | X | Y | Z |
| A | Na | NaOH | NaHCO3 |
| B | Cu | CuSO4 | Cu(OH)2 |
| C | C | CO | CO2 |
| D | Si | SiO2 | H2SiO3 |

 C
C
 A+B
A+B