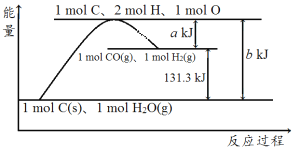
题目内容
【题目】东晋![]() 华阳国志
华阳国志![]() 南中志
南中志![]() 卷四中已有关于白铜的记载,云南镍白铜
卷四中已有关于白铜的记载,云南镍白铜![]() 铜镍合金
铜镍合金![]() 闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)已知:丁二酮肟[HON=(CH3)CC(CH3)=NOH]是检验Ni2+的灵敏试剂。丁二酮肟分子中C原子轨道杂化类型为___,1mol丁二酮肟分子所含σ键的数目为___。
(2)单质铜及镍都是金属晶体;铜晶体的堆积方式为___;元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(3)铁和氨气在640℃可发生置换反应,产物之一的晶胞结构见图(1)。写出该反应的化学方程式:___。
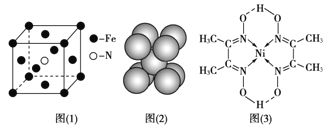
(4)下列关于铁和镍及其化合物说法正确的是___
a.金属镍能与CO形成配合物Ni(CO)4,常温下为液态,易溶于CCl4、苯等有机溶剂。所以Ni(CO)4固态时属于分子晶体
b.[Ni(NH3)6]SO4中阴离子的立体构型是正八面体
c.Ni2+和Fe2+的半径分别为69pm和78pm,则晶格能NiO>FeO,熔点NiO>FeO
d.铁晶胞结构见图(2),每个晶胞含有2个铁原子
(5)配合物Y的结构见图(3),Y中含有的化学键有___![]() 填序号
填序号![]() ;
;
a.极性共价键 b.非极性共价键 c.配位键 d.氢键 e.离子键 f.金属键
【答案】sp3和sp2 15NA或(9.03×1024) 面心立方堆积 铜失去的是全充满的3d10电子,镍失去的是4s1电子 8Fe+2NH3![]() 2Fe4N+3H2 acd abcd
2Fe4N+3H2 acd abcd
【解析】
![]() 丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为
丁二酮肟分子中C原子,甲基上碳原子价层电子对个数是4且不含孤电子对,为![]() 杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为
杂化,连接甲基的碳原子含有3个价层电子对且不含孤电子对,为![]() 杂化,丁二酮肟的结构式为
杂化,丁二酮肟的结构式为 ,分子中含有13个单键,和2个双键,则共含有15个
,分子中含有13个单键,和2个双键,则共含有15个![]() 键,所以1mol丁二酮肟含有
键,所以1mol丁二酮肟含有![]() 键数目为
键数目为![]() 或
或![]()
故答案为:![]() 和
和![]() ;
;![]() 或
或![]() ;
;
![]() 由Cu晶体的晶胞图
由Cu晶体的晶胞图 可知,铜晶体的堆积方式为面心立方最密堆积,单质铜及镍都是金属晶体,都是由金属键形成的晶体,
可知,铜晶体的堆积方式为面心立方最密堆积,单质铜及镍都是金属晶体,都是由金属键形成的晶体,
元素铜与镍的第二电离能分别为![]()
![]() 、
、![]()
![]() ,
,![]() ,考虑到铜失去的是全充满的
,考虑到铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子,后者失去较前者容易,
电子,后者失去较前者容易,
故答案为:面心立方堆积;铜失去的是全充满的![]() 电子,镍失去的是
电子,镍失去的是![]() 电子;
电子;
![]() 该晶胞中铁原子个数
该晶胞中铁原子个数![]() ,氮原子个数是1,所以氮化铁的化学式是
,氮原子个数是1,所以氮化铁的化学式是![]() ,铁和氨气在
,铁和氨气在![]() 可发生置换反应生成氢气和氮化铁,所以该反应方程式为:
可发生置换反应生成氢气和氮化铁,所以该反应方程式为: ,
,
故答案为: ;
;
![]() 因为
因为![]() 常温下为液态,易溶于
常温下为液态,易溶于![]() 、苯等有机溶剂,根据相似相溶原理知,固态
、苯等有机溶剂,根据相似相溶原理知,固态![]() 属于分子晶体,故a正确;
属于分子晶体,故a正确;
![]() 中阴离子
中阴离子![]() 中S原子的孤电子对数
中S原子的孤电子对数![]() ,价层电子对数
,价层电子对数![]() ,离子空间构型为正四面体,故b错误;
,离子空间构型为正四面体,故b错误;
![]() 影响离子晶体熔点的因素是晶格能,晶格能与离子半径成反比、与电荷数成正比,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,故c正确;
影响离子晶体熔点的因素是晶格能,晶格能与离子半径成反比、与电荷数成正比,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,故c正确;
![]() 铁晶胞中铁占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:
铁晶胞中铁占据8个顶点和中心,根据均摊法确定其晶胞中的原子数为:![]() ,故d正确;
,故d正确;
故答案为:acd;
![]() 根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选abcd,
根据图可知碳碳间形成非极性共价键、碳氮间为极性共价键,氮镍间为配位键,氧氢间形成氢键,无离子键、金属键,故选abcd,
故答案为:abcd。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案